相比MDD,MDR對醫(yī)療器械CE技術文檔及其他資料要求加嚴了許多,對于醫(yī)療器械CE認證?來說,知悉醫(yī)療器械不良事件檢索途徑和方法是必備技能之一。
引言:相比MDD,MDR對醫(yī)療器械CE技術文檔及其他資料要求加嚴了許多,對于醫(yī)療器械CE認證來說,知悉醫(yī)療器械不良事件檢索途徑和方法是必備技能之一。

隨著現(xiàn)代醫(yī)療水平的不斷發(fā)展,醫(yī)療器械已被廣泛地用于疾病的診斷、預防、監(jiān)護、治療或者緩解等。但任何被批準上市的醫(yī)療器械都不是絕對安全的,醫(yī)療器械的使用必然帶來某種程度的風險。已批準上市的醫(yī)療器械在正常使用情況下,會導致或者可能導致人體傷害的各種有害事件發(fā)生,各種有害事件的發(fā)生將會給患者的生命安全帶來極大威脅。為降低醫(yī)療器械不良事件發(fā)生概率,建立不良事件監(jiān)測與評價體系十分必要,只有通過持續(xù)開展對醫(yī)療器械不良事件的監(jiān)測,才可以及時、有效地發(fā)現(xiàn)不良事件,為管理部門對存在安全隱患的產品采取相應的行政措施提供科學依據(jù),避免或減少同類不良事件在不同時間、地點的重復發(fā)生。
目前很多國家已建立了醫(yī)療器械不良事件監(jiān)測系統(tǒng),對于已收集到的不良事件也會定期公布,供公眾檢索。本文匯總了中國NMPA、美國FDA、英國MHRA、澳大利亞TGA、加拿大Health Canada、日本PMDA、德國BfArM等國家的醫(yī)療器械不良事件檢索方式,并提供了對于已檢索到的醫(yī)療器械不良事件進行匯總分析的方法,以期為行業(yè)內進行醫(yī)療器械不良事件監(jiān)測的人員提供參考。
一、醫(yī)療器械不良事件監(jiān)測來源
(一)中國
國家藥品不良反應監(jiān)測中心發(fā)布:
《醫(yī)療器械不良事件信息通報》
《醫(yī)療器械警戒快訊》
(二)美國
不良事件查詢數(shù)據(jù)庫MAUDE
召回查詢數(shù)據(jù)庫Recall
按年份查詢警告信(warning letter)
(三)英國
英國醫(yī)療器械警報(MHRA)
(四)加拿大
召回和警戒
(五)澳大利亞TGA
不良事件
召回
警戒
(六)日本PMDA
PMDA網(wǎng)站
(七)德國BfArM
發(fā)布FSCAs(Field Corrective Actions)
二、醫(yī)療器械不良事件監(jiān)測方向
(一)以數(shù)據(jù)庫為方向,開展醫(yī)療器械不良事件監(jiān)測工作
開展醫(yī)療器械不良事件監(jiān)測可以數(shù)據(jù)庫為方向,不同的數(shù)據(jù)庫有其各自的特點,例如中國《醫(yī)療器械不良事件信息通報》是國家藥品不良反應監(jiān)測中心每年定期對某一類產品的不良事件進行的通報,而《醫(yī)療器械警戒快訊》數(shù)據(jù)庫中所列不良事件主要收集的是美國FDA、英國MHRA、澳大利亞TGA以及加拿大Health Canada的警示或召回數(shù)據(jù),并非境內上報數(shù)據(jù);美國MAUDE數(shù)據(jù)庫屬于全數(shù)據(jù)庫,只要按照FDA法規(guī)進行報告的MDR,都會錄入該數(shù)據(jù)庫,但當涉及的檢索結果數(shù)據(jù)量非常大的時候,只能返回500條記錄,需要通過限制條件來精確檢索;英國MHRA、加拿大Health Canada、澳大利亞TGA、德國BfArM等關于醫(yī)療器械不良事件/召回/警戒信息的數(shù)據(jù)庫會定時更新,可根據(jù)關鍵詞進行進一步篩選,還可通過限制時間或限制關鍵詞的位置等進行精確檢索。
(二)以產品名稱為方向,開展醫(yī)療器械不良事件監(jiān)測工作
以產品名稱為方向開展醫(yī)療器械不良事件監(jiān)測,可通過在已選擇的數(shù)據(jù)庫的檢索頁面輸入預期要進行監(jiān)測的醫(yī)療器械產品名稱,一般不需要輸入太過具體的產品名稱,例如監(jiān)測髖關節(jié)假體的不良事件,可輸入hip joint,然后可通過限制檢索時間進行相關產品不良事件信息收集。然而對于美國MAUDE數(shù)據(jù)庫的檢索,因其數(shù)據(jù)量很大,可進一步通過限制product code進行精確檢索。例如髖關節(jié)產品,包含33個product code,如全髖關節(jié)置換系統(tǒng)LZO;半髖關節(jié)置換系統(tǒng)KWY;非骨水泥型的髖關節(jié)假體系統(tǒng)OQG;髖關節(jié)假體系統(tǒng)(不含股骨柄,骨水泥或非骨水泥)KWZ、PBI;髖關節(jié)假體(股骨部件)JDG、KWL、LWJ;髖關節(jié)股骨部件,表面置換KXA、NXT;髖關節(jié)股骨部件,半髖JDH;等等。
(三)以生產企業(yè)名稱為方向,開展醫(yī)療器械不良事件監(jiān)測工作
根據(jù)醫(yī)療器械企業(yè)名稱,在監(jiān)測來源中提及的各大數(shù)據(jù)庫中通過企業(yè)名稱檢索限定時間范圍內的醫(yī)療器械產品的不良事件信息,在檢索時,尤其是進口醫(yī)療器械企業(yè)名稱,需要注意其企業(yè)名稱的不同表示方式,例如大小寫的區(qū)別,縮寫的情況等。
三、醫(yī)療器械不良事件案例解析
(一)醫(yī)療器械不良事件監(jiān)測研究報告
醫(yī)療器械不良事件監(jiān)測研究報告中的內容可包括但不限于如下組成部分:對醫(yī)療器械不良事件監(jiān)測的目的,監(jiān)測計劃等進行簡要概述;監(jiān)測數(shù)據(jù)來源;檢索不良事件的時間范圍;不良事件數(shù)量;報告來源;不良事件發(fā)生原因;不良事件的后果;如有不良事件分類可分別列出以及各自所占的比例;各類不良事件所占的比例;針對不良事件采取的措施;該監(jiān)測數(shù)據(jù)及監(jiān)測過程中的感悟,如對于技術審評,產品上市后監(jiān)管,或者生產企業(yè)進行風險管理等方面的啟示。
(二)醫(yī)療器械不良事件案例分析
1.簡要概述
本文以美國FDA網(wǎng)站MAUDE數(shù)據(jù)庫為例,針對全髖關節(jié)置換系統(tǒng)展開不良事件檢索,鑒于數(shù)據(jù)量很大,此次通過限制product code:LZO ,時間限定為2019年6月份,共計檢索出219條信息,刪除19條非不良事件的信息后,剩余200條納入分析。檢索到的關于LZO全髖關節(jié)置換系統(tǒng)的200條不良事件信息均來源于生產企業(yè),其中199條為Injury傷害,1條為Malfunction故障。
2.數(shù)據(jù)匯總分析方法
將數(shù)據(jù)庫中的信息進行逐一摘錄,運用Microsoft Excel軟件從報告來源、發(fā)生不良事件的醫(yī)療器械相關信息(包括生產企業(yè)名稱、醫(yī)療器械產品名稱、器械類型、器械問題)、不良事件發(fā)生的時間、FDA接收到不良事件的時間、事件類型、不良事件發(fā)生原因等方面進行數(shù)據(jù)匯總。
3.結果分析
3.1總體描述
所檢索到的200條醫(yī)療器械不良事件其中111條明確與股骨頭相關,54條明確與股骨柄相關,17條與髖臼外杯相關(其中4條與髖臼杯上螺釘有關),15條與髖臼內襯相關,3條不確定具體引發(fā)不良事件的部件。具體各類別占比情況如圖1所示。
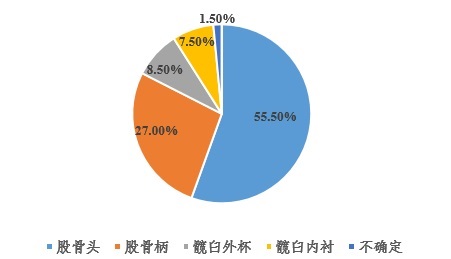
圖1 MAUDE數(shù)據(jù)庫中全髖關節(jié)假體系統(tǒng)各個部件出現(xiàn)不良事件占比(基于2019年6月份數(shù)據(jù))
收集到的111條由股骨頭部件引發(fā)的不良事件均為術后發(fā)生,即患者在行初次髖關節(jié)置換術后引起的,其中有79條,占比71.17%明確進行了翻修。收集到的54條由股骨柄部件引發(fā)的不良事件均為術后發(fā)生,其中有49條,占比90.74%明確進行了翻修。收集到的17條由髖臼外杯部件引發(fā)的不良事件有2條為術中發(fā)生,包括1條為術中失血過多和1條為術中髖臼螺釘斷裂。有15條為術后發(fā)生,在術后發(fā)生的15條不良事件中有13條,占比86.67%,明確進行了翻修。收集到的15條由髖臼內襯部件引發(fā)的不良事件均為術后發(fā)生,其中13條,占比86.67%,明確進行了翻修。基于上述數(shù)據(jù),髖關節(jié)假體置換術后明確進行翻修的比例達到77.78%(其中不包括檢索數(shù)據(jù)中未明確最終結局的情況)。
3.2不良事件原因分析及應采取的措施
本文對導致全髖關節(jié)假體系統(tǒng)出現(xiàn)不良事件的主要原因進行匯總分析(分析基于現(xiàn)有已檢索數(shù)據(jù))。
3.2.1脫位
其中有59條不良事件引發(fā)的原因包含脫位,髖關節(jié)假體脫位是髖關節(jié)置換術后常見的并發(fā)癥之一,導致術后假體脫位的常見原因包括:(1)術后護理不當,功能鍛煉不當,術后患者過度屈髖、內旋時最易發(fā)生。(2)假體安放位置不當,特別是髖臼杯安放位置不良。(3)關節(jié)周圍軟組織松弛或松解過度,特別是臀中肌松弛無力易發(fā)生。(4)髖臼假體位置過高,股骨頸有效長度過短,股骨柄內翻,導致髖關節(jié)周圍軟組織張力過低,故關節(jié)易脫位。( 5) 手術中髖臼周圍骨贅或溢出的骨水泥清楚不徹底,導致活動時由其引起杠桿支點作用,使股骨頭脫位。髖臼假體位置不良、軟組織不平衡是目前全髖關節(jié)置換術后早期脫位的主要因素[1]。當然筆者認為假體脫位也會與假體的設計有關。因此,術者應掌握規(guī)范的手術要求及器械的操作技巧,保證假體選擇合適且安放到位;也應加強對于患者的臨床康復指導,提示患者在術后的注意要點,防止患者因過早活動或操作不當導致植入物過早失效;加強對于護理人員的教育,如何搬動和翻身,移動時要維持髖關節(jié)伸直、外展中立位,避免髖關節(jié)過度屈曲等。同時,假體研制企業(yè)應加強產品的設計開發(fā)流程控制,確保設計輸出能夠滿足設計輸入的要求,設計出結構合理,性能滿足臨床使用要求,安全有效的醫(yī)療器械產品。
3.2.2材料腐蝕,金屬離子濃度升高
其中有38條不良事件是由于髖關節(jié)假體部件材料腐蝕引起的,主要發(fā)生在股骨部件。髖關節(jié)假體界面間磨損產生的顆粒會釋放金屬離子,從而導致人體內金屬離子濃度的升高,可能造成血管炎、形成炎性假瘤以及軟組織、產生骨破壞等,金屬離子濃度升高主要表現(xiàn)為血液中鈷離子濃度和鉻離子濃度的提高。有文獻研究顯示[2],假體安放位置會影響假體界面間的磨損程度,與金屬離子釋放有密切關系,尤其是髖臼假體外展角和前傾角對關節(jié)承重和摩擦影響較大。同時發(fā)現(xiàn)金屬離子濃度與股骨頭假體直徑成負相關,但并不是說髖關節(jié)置換術中必須選擇大直徑假體,目前仍要結合患者生理結構的匹配程度進行選擇。
3.2.3感染
其中有21條不良事件是由于感染引起的。術后傷口早期感染多因傷口污染所致,如無菌操作不規(guī)范,手術切口暴露時間長,組織牽拉壓迫損傷重,切口沖洗不夠等因素均可導致感染;此外也可因傷口皮下組織缺血壞死、血腫、傷口表淺感染而引起。晚期感染多因患者機體抵抗力下降,身體其他部位發(fā)生感染時細菌經(jīng)血行播散所致[3]。因此在進行全髖關節(jié)置換術時應加強手術室管理、注意應嚴格在無菌環(huán)境下操作,術前做好規(guī)劃避免手術切口的長時間暴露,充分沖洗切口,并在術后做好傷口的引流工作,使感染率降至最低[4]。
3.2.4股骨柄松動和下沉
其中14條不良事件是由于股骨柄松動和下沉引起的。假體松動和下沉是人工髖關節(jié)置換術后最嚴重的并發(fā)癥之一,也是髖關節(jié)翻修術最常見原因之一。導致股骨柄松動、下沉的原因包括:(1)假體固定不牢或保留股骨距過短;(2)過早負重,骨質疏松;(3)骨水泥聚合不均,放置范圍不夠,骨水泥斷裂;(4)假體材料不能與骨組織有機結合;(5)假體磨損,微粒形成,骨溶解或感染;(6)與手術者技術有關[1]。因此進行髖關節(jié)假體置換術時術者應結合患者生理解剖結構,做好術前規(guī)劃,選擇組織相容性好、材質好且尺寸合適的假體;應提高理論及操作技術,并在術前及術后做好患者及其看護人員的預防性指導工作。
3.2.5假體周圍骨折
其中有6條不良事件是由于假體周圍骨折引起。術中發(fā)生假體周圍骨折的可能性較大,術中假體周圍骨折常發(fā)生在轉子區(qū),多發(fā)生于擴髓或置放假體時,與術中的操作失誤有關[3]。避免此類骨折需要周密的術前計劃,精心的術前準備;選擇最合適的假體型號安放,應與髓腔相匹配;擴髓時依次進行,置放假體時應注意假體柄方向與擴髓方向一致,打擊時注意保持適當?shù)牧α浚屑纱直1]。
四、結語
針對醫(yī)療器械不良事件原因分析過程中匯總出的事件發(fā)生原因,對于監(jiān)管部門,對于醫(yī)療機構,尤其對于生產企業(yè)在醫(yī)療器械風險控制方面均具有一定的參考意義。(一)監(jiān)管部門應開展醫(yī)療器械法規(guī)、規(guī)章及規(guī)范性文件的制修訂工作,使得醫(yī)療器械有法可依,有規(guī)可循;應加強醫(yī)療器械上市后監(jiān)管,定期收集匯總醫(yī)療器械在上市后出現(xiàn)的不良事件、警戒及召回事件,并及時發(fā)布公告;加強對醫(yī)療器械生產企業(yè)的監(jiān)管,通過對醫(yī)療器械生產企業(yè)的監(jiān)管以規(guī)范其生產流程,從源頭上有效避免不良事件的發(fā)生;同時應持續(xù)推進醫(yī)療器械監(jiān)管科學研究,構建基于精準風險控制的評價監(jiān)管體系。(二)醫(yī)療機構應加強培訓和管理,臨床醫(yī)生應掌握規(guī)范的手術要求及器械的操作技巧。應加強醫(yī)工結合的作用,臨床醫(yī)生可就醫(yī)療器械在臨床使用過程中的好或不好的問題與器械設計工程師交流,使臨床醫(yī)生能夠更全面地了解所使用的醫(yī)療器械,也有助于器械設計工程師更好的設計或改進醫(yī)療器械。應加強臨床康復指導,提示患者在術后的注意要點,防止患者因過早活動或操作不當導致植入物過早失效。同時應提高臨床醫(yī)生對于醫(yī)療器械不良事件的認知,及時規(guī)避醫(yī)療器械的使用風險,并能收集和上報醫(yī)療器械不良事件。(三)生產企業(yè)應加強醫(yī)療器械產品全生命周期風險管控,充分識別醫(yī)療器械產品潛在風險,并采取適當措施將風險降低至可接受水平。應加強原材料控制,采用符合標準要求的原材料進行醫(yī)療器械生產制造,避免因原材料導致的醫(yī)療器械安全有效性問題。應加強產品的設計開發(fā)流程控制,確保設計輸出能夠滿足設計輸入的要求,設計出結構合理,性能滿足臨床使用要求,安全有效的醫(yī)療器械產品。應嚴格控制生產環(huán)節(jié)的各個流程,關鍵生產工藝經(jīng)過嚴格的驗證和確認,醫(yī)療器械產品放行前嚴格把關,確保終產品質量符合產品技術要求及臨床使用要求。