近日有客戶咨詢到有關醫療器械法規標準體系相關事項,所以,以3D打印椎間融合器這個產品為例�,為大家科普醫療器械注冊產品適用醫療器械法規標準體系�。
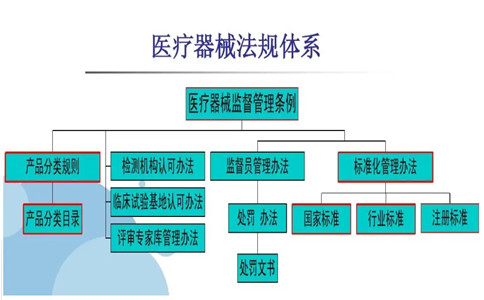
一��、產品適用醫療器械法規標準:
3D打印椎間融合器適用醫療器械法規標準���。包括但不僅限于以下:
GB/T 228.1金屬材料拉伸試驗第1部分室溫試驗方法
GB/T 10610 產品幾何技術規范(GPS) 表面結構輪廓法評定表面結構的規則和方法
GB/T 5168 α-β鈦合金高低倍組織檢驗方法
GB/T 4698 (所有部分) 海綿鈦�、鈦及鈦合金化學分析方法
GB/T 13810 外科植入物用鈦及鈦合金加工材
GB/T 33582 機械產品結構有限元力學分析通用原則
YY/T 0316 醫療器械風險管理對醫療器械的應用
YY/T 1427 外科植入物可植入材料及醫療器械靜態和動態腐蝕試驗的測試溶液和條件
YY/T 1552 外科植入物評價金屬植入材料和醫療器械長期腐蝕行為的開路電位測量方法
GB/T 14233.1醫用輸液�、輸血、注射器具檢驗方法第1部分:化學分析方法
GB/T 14233.2醫用輸液��、輸血���、注射器具檢驗方法第2部分:生物學試驗方法
GB/T 16886.1醫療器械生物學評價第1部分:風險管理過程中的評價與試驗
GB/T 35021 增材制造工藝分類及原材料
GB/T 35351 增材制造術語
GB/T 36984外科植入物用多孔金屬材料X射線CT檢測方法
YY 0341.2 無源外科植入物骨接合與脊柱植入物第2部分:脊柱植入物特殊要求
YY/T 1502 脊柱植入物椎間融合器
YY/T 0343外科金屬植入物液體滲透檢驗
YY/T 0640 無源外科植入物通用要求
YY/T 0466.1 醫療器械用于醫療器械標簽�、標記和提供信息的符號第1部分:通用要求
YY/T 0959 脊柱植入物椎間融合器力學性能試驗方法
YY/T 0960 脊柱植入物椎間融合器靜態軸向壓縮沉陷試驗方法
GB 18278系列標準
GB 18279 系列標準
GB 18280 系列標準
WS310.2 《醫院消毒供應中心第2部分:清洗消毒及滅菌技術操作規范》
ASTM F2077 Test Methods for Intervertebral Body Fusion Devices
ASTM F2267 Standard Test Method for Measuring Load Induced Subsidence of Intervertebral Body Fusion Device Under Static Axial Compression
ASTM F2119 Standard Test Method for Evaluation of MR Image Artifacts from Passive Implants
ASTM F2182 Standard Test Method for Measurement of Radio Frequency Induced Heating Near Passive Implants During Magnetic Resonance Imaging
ASTM F2213 Standard Test Method for Measurement of Magnetically Induced Torque on Medical Devices in the Magnetic Resonance Environment
ISO 17296-2 Additive manufacturing -- General principles -- Part 2: Overview of process categories and feedstock
ISO 17296-3 Additive manufacturing -- General principles -- Part 3: Main characteristics and corresponding test methods
ISO 17296-4 Additive manufacturing -- General principles -- Part 4: Overview of data processing
ISO 19227 Implants for surgery -- Cleanliness of orthopedic implants -- General requirements
ASTM F3335 Standard Guide for Assessing the Removal of Additive Manufacturing Residues in Medical Devices Fabricated by Powder Bed Fusion ASTM F3122 Standard Guide for Evaluating Mechanical Properties of Metal Materials Made via additive manufacturing process
ISO/ASTM 52921 Standard terminology for additive manufacturing -- Coordinate systems and test methodologies
ISO/ASTM52915 Specification for additive manufacturing file format (AMF) Version 1.2
ISO/ASTM 52901 Additive manufacturing -- General principles -- Requirements for purchased AM parts
ISO/ASTM 52900 Additive manufacturing -- General principles – Terminology
ISO/ASTM 52910 Additive manufacturing -- Design -- Requirements, guidelines and recommendations
ASTM F2924 Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium with Powder Bed Fusion
ASTM F3001 Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium ELI (Extra Low Interstitial) with Powder Bed Fusion
ASTM F3049 Standard Guide for Characterizing Properties of Metal Powders Used for Additive Manufacturing Processes
二、產品適用的醫療器械注冊技術審評指導原則:
《醫療器械注冊單元劃分指導原則》
《椎間融合器注冊技術審查指導原則》
《無源植入性醫療器械貨架有效期注冊申報資料指導原則(2017年修訂版)》
《醫療器械動物試驗研究注冊審查指導原則第一部分:決策原則(2021年修訂版)》
《醫療器械動物試驗研究注冊審查指導原則第二部分:試驗設計���、實施質量保證》
《醫療器械臨床評價技術指導原則》
《醫療器械臨床試驗質量管理規范》
《接受醫療器械境外臨床試驗數據技術指導原則》