2022年6月23日,藥監(jiān)總局發(fā)布中醫(yī)熏蒸治療設(shè)備注冊審查指導原則(征求意見稿),對于中醫(yī)熏蒸治療設(shè)備注冊企業(yè)來說,可以好好讀讀。
2022年6月23日,藥監(jiān)總局發(fā)布中醫(yī)熏蒸治療設(shè)備注冊審查指導原則(征求意見稿),對于中醫(yī)熏蒸治療設(shè)備注冊企業(yè)來說,可以好好讀讀。

中醫(yī)熏蒸治療設(shè)備注冊審查指導原則(征求意見稿)
本指導原則旨在指導注冊申請人對中醫(yī)熏蒸治療設(shè)備注冊申報資料的準備及撰寫,同時也為技術(shù)審評部門提供參考。
本指導原則是對中醫(yī)熏蒸治療設(shè)備的一般要求,注冊申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用。若不適用,需具體闡述理由及相應(yīng)的科學依據(jù),并依據(jù)產(chǎn)品的具體特性對注冊申報資料的內(nèi)容進行充實和細化。
本指導原則是供注冊申請人和技術(shù)審評人員使用的指導性文件,但不包括審評審批所涉及的行政事項,亦不作為法規(guī)強制執(zhí)行,應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導原則。如果有能夠滿足相關(guān)法規(guī)要求的其他方法,也可以采用,但是需要提供詳細的研究資料和驗證資料。
本指導原則是在現(xiàn)行法規(guī)和標準體系以及當前認知水平下制定,隨著法規(guī)和標準的不斷完善,以及科學技術(shù)的不斷發(fā)展,相關(guān)內(nèi)容也將適時進行調(diào)整。
一、適用范圍
本指導原則適用于基于中醫(yī)醫(yī)理,通過對藥液加熱后所產(chǎn)生的蒸汽,對人體進行中藥熏蒸的設(shè)備,不含藥物。根據(jù)《醫(yī)療器械分類目錄》,產(chǎn)品管理類別為二類,分類編碼為20-02-05。不適用于常溫下的超聲霧化設(shè)備。
二、注冊審查要點
(一)監(jiān)管信息
1.產(chǎn)品名稱
應(yīng)為通用名稱,并符合《醫(yī)療器械通用名稱命名規(guī)則》、《中醫(yī)器械通用名稱命名指導原則》要求。采用《醫(yī)療器械分類目錄》或國家標準、行業(yè)標準上的通用名稱,如熏蒸治療儀、熏蒸治療艙、熏蒸床。
2.注冊單元劃分
應(yīng)按照《醫(yī)療器械注冊與備案管理辦法》、《醫(yī)療器械注冊單元劃分指導原則》要求,著重考慮產(chǎn)品的技術(shù)原理、結(jié)構(gòu)組成、性能指標、適用范圍等因素進行綜合判定。
如封閉式熏蒸儀與開放式熏蒸儀在結(jié)構(gòu)組成、性能指標、適用范圍等方面存在較大差異,建議劃分為不同的注冊單元。
(二)綜述資料
1. 結(jié)構(gòu)組成
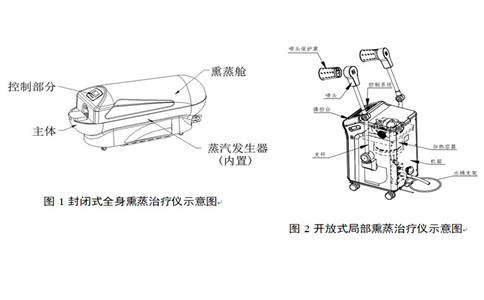
該產(chǎn)品一般由蒸汽發(fā)生部分、蒸汽輸出部分(熏蒸艙、熏蒸床、噴頭等)、控制部分等組成。
不同生產(chǎn)企業(yè)的產(chǎn)品,在結(jié)構(gòu)上存在一定差異,可以與本部分描述不完全一致,組成部分的名稱也不限于文中描述。
2. 組成單元結(jié)構(gòu)/功能描述
申請人應(yīng)根據(jù)產(chǎn)品實際,描述產(chǎn)品主要功能、各組成部件的功能以及區(qū)別于同類產(chǎn)品的特征。
(1)蒸汽發(fā)生部分:該部分實現(xiàn)將藥液進行汽化,并擴散。應(yīng)明確加熱方式,如加熱膜、加熱棒。明確盛藥容器的具體形式、材料,是否為壓力容器。
(2)蒸汽輸出部分:該部分實現(xiàn)將蒸汽傳送到熏蒸區(qū)域。明確蒸汽的傳送方式,明確產(chǎn)品的熏蒸方式,如熏蒸艙、熏蒸床、噴頭等。
(3)控制部分:該部分實現(xiàn)對熏蒸過程的溫度、液位、時間、蒸汽量、報警等指標的控制、顯示、輸出。應(yīng)明確具體的控制部件、控制方式、控制參數(shù)。
3. 產(chǎn)品的種類劃分及實例
按治療部位可分為:局部熏蒸治療儀和全身熏蒸治療儀;
按治療方式可分為:開放式熏蒸治療儀和封閉式熏蒸治療儀。
4.產(chǎn)品的適用范圍/預期用途、禁忌證
(1)適用范圍:
通常描述為:在醫(yī)療機構(gòu)內(nèi)使用,與藥液配合,用于人體局部或軀干部位的熏蒸治療,應(yīng)明確局部的具體部位。
(2)適用人群或禁忌證:
有嚴重心血管疾病,孕婦,惡性貧血,月經(jīng)期,活動性肺結(jié)核,高熱患者禁用。年老、體弱者慎用。
5. 產(chǎn)品的不良事件歷史記錄
申請人在風險分析時應(yīng)關(guān)注同品種醫(yī)療器械產(chǎn)品的不良事件歷史記錄。
經(jīng)查詢國家藥監(jiān)局網(wǎng)站,熏蒸類設(shè)備使用風險的不良事件信息通報中明確:國家藥品不良反應(yīng)監(jiān)測中心共收到涉及熏蒸類設(shè)備的可疑不良事件報告223例。其中嚴重傷害事件93例,主要表現(xiàn)為暈厥、燙傷、驚嚇等,其中發(fā)生暈厥2例,占全部嚴重傷害報告2.1%;不同程度燙傷78例,占83.9%;艙體墜落、爆炸等瀕臨事件13例,占14.0%。
(三)非臨床資料
1.產(chǎn)品風險管理資料
申請人參照YY/T 0316《醫(yī)療器械 風險管理對醫(yī)療器械的應(yīng)用》中的規(guī)定,并結(jié)合產(chǎn)品本身的特點對產(chǎn)品風險進行全生命周期的管理,如產(chǎn)品的高溫、高濕特性。風險管理活動要貫穿產(chǎn)品設(shè)計、生產(chǎn)、上市后使用及產(chǎn)品處理的整個生命周期。風險管理報告可包含風險分析、風險評價、風險控制、風險監(jiān)測,應(yīng)符合YY/T 0316的有關(guān)要求,審查要點包括:
(1)是否正確識別醫(yī)療器械預期用途和與安全有關(guān)特征(依據(jù)YY/T 0316 附錄C);
(2)是否系統(tǒng)識別正常和故障兩種條件下的可預見危險(源)(依據(jù)YY/T 0316附錄E,基于已識別的安全有關(guān)特征);
(3)是否利用風險管理計劃中規(guī)定的可接受性準則,對風險進行評價并進行風險控制,也包括綜合剩余風險的可接受性評價(依據(jù)YY/T 0316 附錄D)。
以下表1給出了產(chǎn)品常見的風險要素及示例。由于不同產(chǎn)品的工作原理、結(jié)構(gòu)組成、性能指標存在差異,所以這些風險要素并不是全部,申請人還應(yīng)根據(jù)產(chǎn)品特點確定其他風險并進行有效控制。
表1 產(chǎn)品常見的風險要素及示例
危險(源)分類 | 可能的原因 | 造成的后果 |
能量 危險 | 電磁能 | 設(shè)備受到電磁干擾 | 設(shè)備運行異常或不能工作 |
漏電流 | 操作人員接觸到帶電部分 | 患者或操作者受到電擊傷害 |
熱能 | 設(shè)備溫度超出限定值,時間不到設(shè)定值 | 患者造成損傷或達不到治療效果 |
冷凝水滴落到患者皮膚,造成傷害 | 患者燙傷 |
接觸高溫器件表面 | 患者燙傷,甚至昏厥 |
機械能 | 門不能打開 | 患者恐慌,甚至受傷 |
| 支撐桿故障等原因造成艙體墜落 | 患者受到驚嚇,甚至昏厥 |
生物學危險 | 細菌感染 | 與人體接觸的部件未經(jīng)清洗、消毒引起的交叉感染 | 患者或操作者接觸導致感染 |
生物相容性 | 與人體接觸部分的原材料有毒有害對人體造成的危害 | 患者皮膚瘙癢、紅腫 |
化學 危險 | 化學 殘留 | 清潔或消毒殘留物超標,刺激皮膚 | 對人體產(chǎn)生潛在的危害 |
信息 危險 | 標記 | 標記缺少或不正確,標記的位置不正確,不能永久貼牢和清楚易認等。 | 設(shè)備的狀態(tài)不明,相關(guān)信息不明 |
操作說明書 | 說明書未對消毒等維護信息作出詳細說明;說明書對產(chǎn)品配合使用的藥品類型、使用限制等描述不規(guī)范、不完整;說明書未對故障排查作詳細說明;說明書未對合理可預見的誤用進行警告 | 非預期使用;設(shè)備不能正常工作;損壞設(shè)備;使用者受到電氣傷害 |
操作 危險 | 使用 錯誤 | 在注冊申請人規(guī)定的使用環(huán)境條件外使用產(chǎn)品;盛藥容器未按說明書要求及時清洗;使用不適用的藥物 | 損壞設(shè)備;管路堵塞、加熱時液體溢出;產(chǎn)品壽命降低,嚴重時導致使用者受到電氣傷害 |
2. 產(chǎn)品技術(shù)要求的主要性能指標
產(chǎn)品技術(shù)要求應(yīng)按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導原則》的規(guī)定編制,各部分具體要求如下。
2.1.產(chǎn)品型號規(guī)格及其劃分說明
產(chǎn)品可按預期用途、結(jié)構(gòu)組成等劃分為不同型號和規(guī)格。
若有產(chǎn)品有多個型號,應(yīng)提供型號間的主要差異對比表。
若含有軟件,應(yīng)按照《醫(yī)療器械軟件注冊技術(shù)審查指導原則》的要求,明確相應(yīng)信息,如軟件的名稱、型號規(guī)格、發(fā)布版本、版本命名規(guī)則等。
附錄中明確非檢驗的技術(shù)信息,如產(chǎn)品圖示、可配合使用藥物或不可使用藥物。
2.2.一般性能
產(chǎn)品一般符合YY/T 1306《熏蒸治療儀》的適用條款。如有不適用條款,申請人需在申報資料中說明理由,并提供充分證據(jù)證明相關(guān)的風險得到有效的控制。
2.3.安全性能
電氣安全應(yīng)符合GB 9706.1的要求。
電磁兼容應(yīng)符合YY 9706.102 (YY0505)的要求。
2.4.其他
產(chǎn)品具有的其他特定功能,應(yīng)參考相應(yīng)標準制定相應(yīng)的性能,如床體的要求、軟件功能、消毒功能等。具有壓力容器的,應(yīng)考慮GB/T 150系列標準。考慮報警的適用性,結(jié)合產(chǎn)品的設(shè)計,出現(xiàn)超溫等風險時處理方式。
3.注冊檢驗典型性
檢驗產(chǎn)品典型性原則應(yīng)是同一注冊單元內(nèi)能夠代表本單元內(nèi)其他產(chǎn)品安全性和有效性的產(chǎn)品。應(yīng)考慮功能最齊全、結(jié)構(gòu)最復雜、風險最高的產(chǎn)品。
如果檢測一個型號不能覆蓋其他型號的全部性能功能,則可對其他型號不能覆蓋的部分進行差異檢測。技術(shù)審評重點關(guān)注檢測內(nèi)容是否與產(chǎn)品技術(shù)要求一致。
4.產(chǎn)品的研究要求
4.1.產(chǎn)品性能研究
產(chǎn)品的一般性能指標建議參照YY/T 1306及產(chǎn)品自身特點制定,若產(chǎn)品結(jié)構(gòu)特征、預期用途、使用方式等與YY/T 1306標準的適用范圍不一致的,申請人可提出不適用條款的說明,并提供相關(guān)資料。明確熏蒸氣體的輸送路徑、與空氣的混和方式,結(jié)合臨床需求,明確可以提供給熱能力、產(chǎn)生蒸汽的能力。明確溫度范圍、精度的設(shè)定依據(jù)。明確盛藥容器是否為壓力容器,若是應(yīng)購買具有資質(zhì)的產(chǎn)品。若為封閉式全身熏蒸,應(yīng)具有緊急停止裝置,并詳細描述該裝置的位置、觸發(fā)方式,說明斷電等故障情況下治療艙的打開方式;若含有可調(diào)節(jié)支桿,應(yīng)明確調(diào)節(jié)角度和調(diào)節(jié)范圍;若為開放式噴頭,說明如何防止燙傷,是否有噴頭保護罩。若產(chǎn)品具有防冷凝水設(shè)計,應(yīng)詳細描述實現(xiàn)過程。若含有熏蒸床,應(yīng)明確是否可調(diào),床體尺寸、鎖止能力、承載能力等。若含有消毒部件,明確消毒的方式、參數(shù)、消毒效果驗證要求等。
4.2.生物相容性研究
應(yīng)根據(jù)GB/T 16886系列標準進行生物相容性評價,應(yīng)提供
預期與患者接觸的部件名稱、部件材料、接觸性質(zhì)(接觸類型、
接觸時間),并提供相應(yīng)評價資料。試驗項目至少應(yīng)包含細胞毒
性、致敏、刺激或皮內(nèi)反應(yīng),其中根據(jù)接觸部位不同,刺激試驗
又分為皮膚刺激、口腔黏膜刺激等類型。樣品制備時應(yīng)考慮高溫的影響。
4.3.清洗消毒滅菌工藝研究
產(chǎn)品使用中,一般為多人重復使用,因此會涉及到終端用戶消毒滅菌。申請人應(yīng)當明確推薦的消毒滅菌工藝(方法和參數(shù))、所推薦消毒滅菌方法確定的依據(jù)以及驗證的相關(guān)研究資料。若可耐受兩次或多次滅菌的產(chǎn)品,應(yīng)當提供產(chǎn)品所推薦滅菌工藝耐受性的研究資料。
4.4.穩(wěn)定性研究
可參考《有源醫(yī)療器械使用期限技術(shù)審查指導原則》要求,提交產(chǎn)品使用期限的研究資料,應(yīng)充分考慮產(chǎn)品高溫、高濕的工作特性。
應(yīng)提交產(chǎn)品的包裝及包裝完整性提供研究資料,應(yīng)參照GB/T14710提交產(chǎn)品環(huán)境試驗的研究資料。注冊申請人應(yīng)結(jié)合聲稱的儲運條件開展包裝和環(huán)境試驗研究,并論述研究設(shè)置的合理性。應(yīng)在申請人所聲稱的儲運條件下進行性能測試,證明運輸和環(huán)境測試后產(chǎn)品能夠保持其完整性和功能性。
4.5.軟件及網(wǎng)絡(luò)安全研究
應(yīng)按照《醫(yī)療器械軟件注冊技術(shù)審查指導原則》提交軟件研究資料。應(yīng)按照《醫(yī)療器械網(wǎng)絡(luò)安全注冊技術(shù)審查指導原則》提交網(wǎng)絡(luò)安全研究資料。
若產(chǎn)品除含嵌入式軟件外,還包含控制型軟件,申請人應(yīng)根據(jù)產(chǎn)品的實際情況,提供完整的軟件驗證資料。
4.6藥物相容性研究
應(yīng)對與熏蒸前后藥液/蒸汽接觸的部件與可熏蒸藥物、高溫的相容性進行研究。應(yīng)排除對高溫敏感、腐蝕性強、易產(chǎn)生殘渣造成管路堵塞的藥物。
4.7其他
根據(jù)產(chǎn)品的具體特性,需提供的其他研究資料。若產(chǎn)品具有的消毒部件,應(yīng)提供對典型適用對象的消毒效果驗證資料,在技術(shù)要求中明確消毒的方式、主要參數(shù)、消毒效果驗等指標。
產(chǎn)品若適用于兒童或用于咽喉、鼻腔、肛腸等非皮膚表面熏蒸,應(yīng)提供相應(yīng)的研究資料,證明高溫下的安全性、對治療部位的有效性。
5.其他資料
熏蒸儀、熏蒸床屬于列入《免于臨床評價醫(yī)療器械目錄》中的產(chǎn)品,申請人需當按照《列入免于臨床評價醫(yī)療器械目錄產(chǎn)品對比說明技術(shù)指導原則》,從基本原理、結(jié)構(gòu)組成、性能、安全性、適用范圍等方面,證明產(chǎn)品的安全有效性。申報產(chǎn)品與對比產(chǎn)品存在差異的,還應(yīng)提交差異部分對安全有效性影響的分析研究資料。
表2 熏蒸儀、熏蒸床免于臨床評價描述
20-02-05 | 熏蒸儀 | 熏蒸儀由藥液箱、進/出液管路、加熱裝置、溫度/液位等控制單元、顯示單元、治療頭等組成(不包括藥物),可按設(shè)計、技術(shù)參數(shù)、適用部位、預期用途、輔助功能等不同分為若干型號;可配合藥液,用于人體局部熏蒸治療。 | Ⅱ |
20-02-05 | 熏蒸床 | 熏蒸床可由床體、控制單元、藥槽、溫度控制器、液位控制器、加熱裝置、液晶顯示屏等組成(不包括藥物);可按設(shè)計、技術(shù)參數(shù)、適用部位、預期用途、輔助功能等不同分為若干型號;可配合藥液,用于人體軀干等部位熏蒸治療。 | Ⅱ |
(四)臨床評價資料
對于符合《免于臨床評價醫(yī)療器械目錄》(以下簡稱《目錄》)下分類編碼為20-02-05的熏蒸儀或熏蒸床,該產(chǎn)品列入《免于臨床評價醫(yī)療器械目錄》,申請人無需提交臨床評價資料。對于《目錄》以外的產(chǎn)品,需提交相應(yīng)的臨床評價資料。
(五)產(chǎn)品說明書和標簽要求
產(chǎn)品說明書和標簽應(yīng)符合《醫(yī)療器械說明書和標簽管理規(guī)定》和YY/T 1306 等相關(guān)產(chǎn)品標準的要求。同時還應(yīng)關(guān)注以下內(nèi)容:
1. 配合使用的藥物要求;
2. 與藥液接觸部件的材料;
3. 產(chǎn)品不適用人群的說明;
4. 盛藥容器清洗的方法;
5. 安全性方面的提示,如高溫保護、冷凝水燙傷等;
6. 軟件發(fā)布版本、軟件功能、網(wǎng)絡(luò)安全(若適用);
7. 常見故障及排除方法,若有故障代碼,應(yīng)說明對應(yīng)的故障類型。
三、參考文獻
[1] 醫(yī)療器械監(jiān)督管理條例[Z].
[2] 醫(yī)療器械注冊與備案管理辦法[Z].
[3] 醫(yī)療器械說明書和標簽管理規(guī)定[Z].
[4] 醫(yī)療器械通用名稱命名規(guī)則[Z].
[5] 醫(yī)療器械注冊申報資料要求及說明[Z].
[6] 醫(yī)療器械分類目錄[Z].
[7] 醫(yī)療器械注冊單元劃分指導原則[Z].
[8] 醫(yī)療器械通用名稱命名指導原則[Z].
[9] 中醫(yī)器械通用名稱命名指導原則[Z].
[10] 關(guān)于發(fā)布免于臨床評價醫(yī)療器械目錄的通告[Z].
[11] 列入免于臨床評價醫(yī)療器械目錄產(chǎn)品對比說明技術(shù)指導原則[Z].
[12] 產(chǎn)品技術(shù)要求編寫指導原則[Z].
[13] 國家藥監(jiān)局器審中心關(guān)于發(fā)布醫(yī)療器械軟件注冊審查指導原則(2022年修訂版)的通告[Z].
[14] 國家藥監(jiān)局器審中心關(guān)于發(fā)布醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導原則(2022年修訂版)的通告[Z].
[15] YY/T 1306 熏蒸治療儀[S].
[16] YY 9706.108 醫(yī)用電氣設(shè)備 第1-8部分:基本安全和基本性能的通用要求 并列標準:通用要求,醫(yī)用電氣設(shè)備和醫(yī)用電氣系統(tǒng)中報警系統(tǒng)的測試和指南[S].
[17] GB/T 150 壓力容器 系列標準[S].
[18] GB/T 16886 醫(yī)療器械生物學評價 系列標準[S].
[19] GB/T 20403 普通固定式康復訓練床[S].
四、編寫單位
山東省食品藥品審評查驗中心