盡管新中國醫療器械有序監管之路起步相對較晚,但從第一個醫療器械監管法規制定之日起,領導層就高瞻遠矚、逐步為創新醫療器械注冊審評建立秩序,鋪平道路。自2014年2月,國家藥監部門發布《創新醫療器械特別審批程序(試行)》,不斷為創新醫療器械注冊審評出臺專項制度,有序推進醫療器械產業創新發展。僅2022年初至今,我國獲批上市的創新醫療器械就達到44個,這一數字早已超過了2021年全年的數字。
盡管新中國醫療器械有序監管之路起步相對較晚,但從第一個醫療器械監管法規制定之日起,領導層就高瞻遠矚、逐步為創新醫療器械注冊審評建立秩序,鋪平道路。自2014年2月,國家藥監部門發布《創新醫療器械特別審批程序(試行)》,不斷為創新醫療器械注冊審評出臺專項制度,有序推進醫療器械產業創新發展。僅2022年初至今,我國獲批上市的創新醫療器械就達到44個,這一數字早已超過了2021年全年的數字。
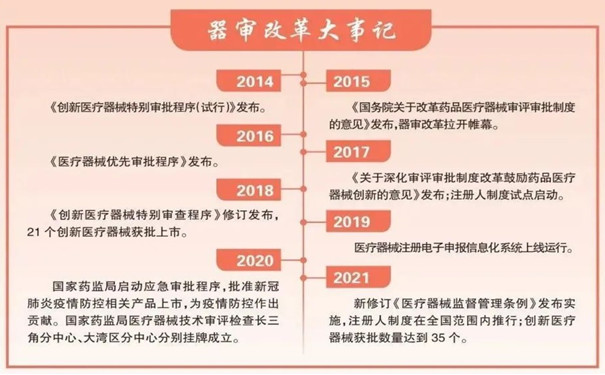
從仿制到創新發展之路,創新醫療器械注冊審批之路越走越平坦:
在開辟特別審查“綠色通道”的同時,為進一步滿足臨床診治需要,另一條快速通道也由此打開。2016年10月,國家藥監部門發布《醫療器械優先審批程序》,對診斷或者治療罕見病、惡性腫瘤、老年人特有和多發疾病、專用于兒童、臨床急需等醫療器械予以優先審批。一旦確定某項目予以優先審批,國家藥監部門將全環節發力加快審評審批:優先進行技術審評,優先安排醫療器械注冊質量管理體系核查,優先進行行政審批……截至2021年底,通過該程序獲批上市的醫療器械達到49個。
此外,為有效預防、及時控制和消除突發公共衛生事件的危害,確保突發公共衛生事件應急所需醫療器械盡快完成審批,國家藥監部門還開辟了醫療器械應急審批通道。
2020年初,面對突如其來的新冠肺炎疫情,國家藥監局第一時間啟動應急審批工作,僅用4天時間就批準了4個新冠病毒核酸檢測產品上市,有力地支持了疫情防控初期工作。截至2021年底,全國共有68個新型冠狀病毒檢測試劑、12個配套儀器設備、5個血液凈化設備及其配套耗材、6個體外心肺支持輔助設備及其配套耗材、10個呼吸機等產品相繼通過應急審評審批上市。相關產品的應急上市,不僅為我國有效控制疫情提供了物資保障,還為全球抗疫提供了中國智慧和中國力量。中國醫藥保健品進出口商會統計顯示,2021年我國防疫物資出口總值達200多億美元,其中體外診斷產品出口額達130.93億美元,同比增長157.37%。
2018年2月27日,上海遠心醫療科技有限公司的單道心電記錄儀獲得了由原上海市食品藥品監管局頒發的第二類醫療器械產品注冊證,成為國內首個按醫療器械注冊人制度試點獲批上市的產品。醫療器械注冊人制度打破了此前產品注冊與生產許可“捆綁”的管理模式,可使注冊人從生產廠房、設施設備的配置與維護中解脫出來。2017年12月,醫療器械注冊人制度試點在上海自貿試驗區啟動。2019年,試點省份擴大到22個,注冊人試點工作加速推進。
2021年6月1日,新修訂《醫療器械監督管理條例》施行,標志著醫療器械注冊人制度在全國范圍內正式推行。