- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
2023年3月8日,藥監總局發布《2022年度醫療器械注冊工作報告》,一起來看2022年這個特別的年度,我國醫療器械注冊工作情況,一起來看看藥監總局及地方藥監、醫療器械行業從業者們做了哪些事,取得了哪些成果。
2022年度醫療器械注冊工作報告(上半部分)
2022年,國家藥監局以習近平新時代中國特色社會主義思想為指導,深入學習貫徹黨的二十大精神,全面落實黨中央國務院重大決策部署,按照習近平總書記“四個最嚴”要求,堅持以人民健康為中心,堅持保安全守底線,促發展追高線,認真執行《醫療器械監督管理條例》,繼續做好疫情防控產品審評審批工作,全面深化醫療器械審評審批制度改革,強化醫療器械注冊管理,助推產業創新高質量發展,醫療器械注冊管理各項工作有力向前推進。
一、醫療器械注冊工作情況
(一)疫情防控服務保障全力以赴
2022年,國家藥監局堅決貫徹落實黨中央國務院重大決策部署,將疫情防控產品應急審批作為重大政治任務。共批準68個新冠病毒檢測試劑,截至2022年年底,共批準新冠病毒檢測試劑136個(包括45個核酸檢測試劑、41個抗體檢測試劑、50個抗原檢測試劑),為疫情防控工作提供了有力保障。持續做好新冠病毒突變株監測和核酸、抗原檢測試劑檢出能力評估,確保已批準試劑對新冠病毒突變株的檢測質量。2022年4月,由我國組織制定的國際標準《體外診斷檢測系統-核酸擴增法檢測新型冠狀病毒(SARS-CoV-2)的要求及建議》獲得ISO批準發布。
2022年,國家藥監局根據疫情防控形勢和要求的變化,全力做好新冠病毒抗原檢測試劑優先審評審批工作,新批準47個新冠病毒抗原檢測試劑,延長已獲批新冠抗原檢測試劑注冊證有效期,充分滿足疫情防控需要。
2022年,國家藥監局還啟動了新冠病毒核酸采樣設備應急審批。組織修訂《醫用外科口罩》《一次性使用醫用口罩》行業標準。全程指導注冊申請人做好體外膜肺氧合(ECMO)產品注冊研發,推動產品盡快上市。
(二) 促進產業創新高質量發展成果豐碩
2022年,國家藥監局按程序做好創新醫療器械、臨床急需醫療器械審評審批,高端醫療裝備國產化有新突破,批準首個國產質子治療系統等創新醫療器械55個(總數為189個),優先審批醫療器械77個(總數為126個),創新醫療器械獲批數量與2021年相比增加57.1%,更好地滿足人民群眾使用高水平醫療器械需要。
2022年,工業和信息化部、國家藥監局聯合印發人工智能醫療器械創新任務揭榜入圍單位名單,啟動生物醫用材料創新任務揭榜掛帥工作,進一步激發產業發展活力。
2022年,國家藥監局落實國家重大區域發展戰略要求,印發港澳醫療器械注冊人在粵港澳大灣區內地9市生產醫療器械實施方案,進一步推動區域產業發展。牽頭組織推進海南博鰲樂城國際醫療旅游先行區臨床真實世界數據應用試點工作,批準熱蒸汽治療設備及一次性使用前列腺熱蒸汽治療器械4個試點品種上市,指導召開了首屆博鰲藥械真實世界研究大會,真實世界數據應用和研究取得新突破。
(三)醫療器械注冊審評審批工作持續規范
2022年,國家藥監局修訂發布《關于第一類醫療器械備案有關事項的公告》,加強備案工作培訓指導,完成全部“冷敷貼”“冷敷凝膠”產品備案清理,及時糾正顯微針、口鼻氣霧給藥器等備案不規范行為。開展境內第二類醫療器械注冊清理規范,梳理第二類醫療器械近80000件,組織抽查31個省168個案卷,有效規范第二類醫療器械注冊工作秩序。
2022年,國家藥監局會同國家衛生健康委修訂發布《醫療器械臨床試驗質量管理規范》(GCP),進一步規范臨床試驗過程,確保臨床試驗結果真實、準確、完整和可追溯。開展2022年度醫療器械臨床試驗監督檢查(包括臨床試驗產品的真實性核查)。發布《醫療器械注冊質量管理體系核查指南》,提高醫療器械注冊人制度下醫療器械注冊質量管理體系核查工作質量。
(四)醫療器械注冊管理技術支撐體系不斷完善
2022年,國家藥監局持續完善醫療器械標準體系,批準醫療器械行業標準制修訂計劃項目116項,審核發布行業標準114項,將92項強制性行業標準和在研項目轉化為推薦性,廢止20項強制性行業標準,標準體系覆蓋性、系統性不斷提升。會同工業和信息化部,組建醫療裝備產業與應用標準化工作組。成立中醫器械標準化技術歸口單位,籌建口腔數字化醫療器械標準化技術歸口單位、醫療器械可靠性與維修性標準化技術歸口單位。部署對標委會開展首次全覆蓋式考核評估。統籌推進新版GB 9706系列標準實施,強化省級藥品監管部門、注冊人責任,印發《GB 9706.1-2020及配套并列標準、專用標準實施工作方案》,全覆蓋開展宣貫培訓,研究制定新版GB 9706標準檢測設備清單、檢驗操作規程和檢驗報告編制規范等。
2022年,國家藥監局加強完善醫療器械分類管理工作,完成分類技術委員會換屆。及時研究明確熱瑪吉、水光針產品管理屬性和類別,修訂發布《關于醫用透明質酸鈉產品管理類別的公告》,發布《關于調整<醫療器械分類目錄>部分內容的公告》,根據醫療器械風險程度,科學合理地調整有關產品描述、預期用途、管理類別等。
2022年,國家藥監局持續推進唯一標識工作,督導各省指導企業開展第二批唯一標識實施工作,起草形成《關于做好第三批實施醫療器械唯一標識工作的公告(征求意見稿)》,公開征求意見。
2022年,國家藥監局醫療器械技術審評中心發布技術審查指導原則95項,目前我國醫療器械技術審查指導原則已達529項,對醫療器械分類目錄覆蓋率達86.9%,醫療器械產品安全有效評價工具日趨成熟。
(五)醫療器械注冊管理能力全面提升
2022年,國家藥監局不斷提升醫療器械注冊管理能力。繼續做好政府購買服務項目,加強動態監測和工作績效季度管理,并開展季度評估,購買服務工作進一步規范,技術審評效能進一步提升。加大全國醫療器械技術審評人員培訓力度,舉辦兩期醫療器械注冊法規和注冊管理實務培訓班,制定實訓基地建設工作方案,統籌北京、上海、江蘇、浙江、山東、廣東等6個實訓基地工作,線上開展專業培訓12次,培訓8000多人次。
2022年,國家藥監局全面提升醫療器械注冊信息化水平,2022年10月起,醫療器械注冊主要辦理事項全面實施電子化審評審批,印發《國家藥監局關于全面實施醫療器械電子注冊證的公告》(2022年第91號),2022年11月1日起全面發放醫療器械電子注冊證,國家藥監局全業務流程電子化基本完成。
2022年,國家藥監局持續推進醫療器械監管科學研究工作,組織推進第二批監管科學研究6個重點項目,推動13個醫療器械子項目加快研究進度、加速成果轉化。積極參與國際組織工作,參加IMDRF管理委員會電話會,組織制定2022年GHWP年會及換屆相關工作方案,配合做好換屆籌備和競選相關工作。
二、醫療器械注冊申請受理情況
2022年,國家藥監局依職責共受理醫療器械首次注冊、延續注冊和變更注冊申請共計10571項,與2021年相比減少13.7%。
(一)整體情況
受理境內第三類醫療器械注冊申請5425項,受理進口醫療器械注冊申請5146項。
按注冊品種區分,醫療器械注冊申請8105項,體外診斷試劑注冊申請2466項。
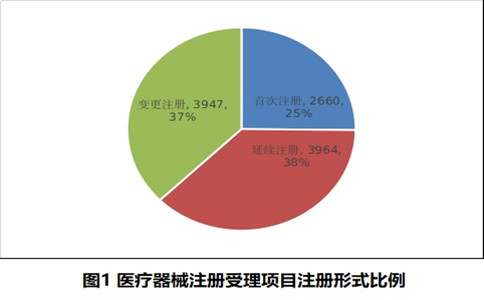
按注冊形式區分,首次注冊申請2660項,占全部醫療器械注冊申請的25.2%;延續注冊申請3964項,占全部醫療器械注冊申請的37.5%;變更注冊申請3947項,占全部醫療器械注冊申請的37.3%。注冊形式比例情況見圖1。
(二)分項情況
1.境內第三類醫療器械注冊受理情況
境內第三類醫療器械注冊受理共5425項,與2021年相比增加1.6%。其中,醫療器械注冊申請4138項,體外診斷試劑注冊申請1287項。
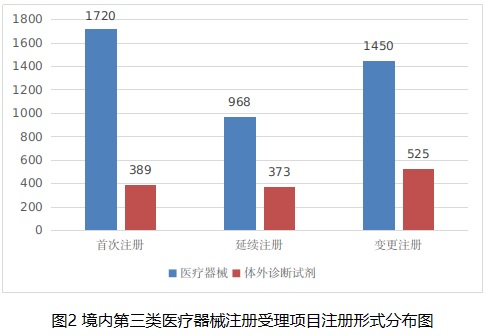
從注冊形式看,首次注冊2109項,占全部境內第三類醫療器械注冊申請數量的38.9%;延續注冊1341項,占全部境內第三類醫療器械注冊申請數量的24.7%;變更注冊1975項,占全部境內第三類醫療器械注冊申請數量的36.4%。注冊形式分布情況見圖2。
2.進口第二類醫療器械注冊受理情況
進口第二類醫療器械注冊受理共2467項,與2021年相比減少33.1%。其中醫療器械注冊申請1590項,體外診斷試劑注冊申請877項。
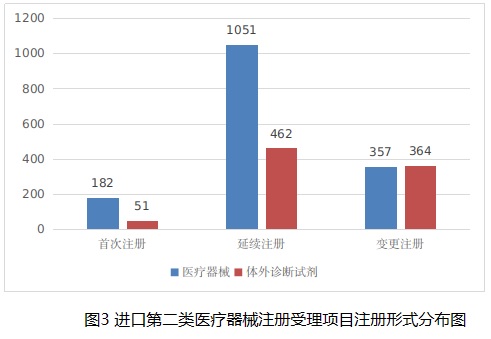
從注冊形式看,首次注冊233項,占全部進口第二類醫療器械注冊申請數量的9.4%;延續注冊1513項,占全部進口第二類醫療器械注冊申請數量的61.3%;變更注冊721項,占全部進口第二類醫療器械注冊申請數量的29.2%。注冊形式分布情況見圖3。
3.進口第三類醫療器械注冊受理情況
進口第三類醫療器械注冊受理共2679項,與2021年相比減少17%。其中醫療器械注冊申請2377項,體外診斷試劑注冊申請302項。
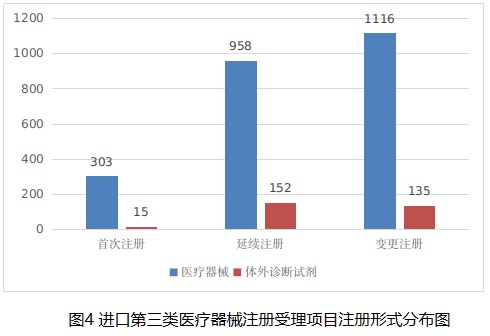
從注冊形式看,首次注冊318項,占全部進口第三類醫療器械注冊申請數量的11.9%;延續注冊1110項,占全部進口第三類醫療器械注冊申請數量的41.4%;變更注冊1251項,占全部進口第三類醫療器械注冊申請數量的46.7%。注冊形式分布情況見圖4。
三、醫療器械注冊審批情況
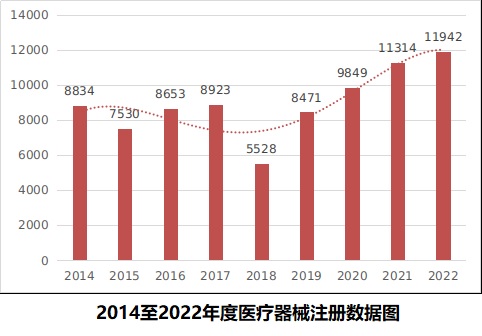
2022年,國家藥監局共批準醫療器械首次注冊、延續注冊和變更注冊11942項,與2021年相比注冊批準總數量增長5.5%。
其中,首次注冊2500項,與2021年相比增加46.2%。延續注冊5218項,與2021年相比減少24.8%。變更注冊4224項,與2021年相比增加58.5%。
2022年,企業自行撤回首次注冊申請、自行注銷注冊證書214項。
近9年國家藥監局批準醫療器械注冊情況見圖5。
(一)整體情況
2022年,國家藥監局批準境內第三類醫療器械注冊5692項,與2021年相比增加23.8%,進口醫療器械6250項,與2021年相比減少7%。
按照注冊品種區分,醫療器械8942項,占全部醫療器械注冊數量的74.9%;體外診斷試劑3000項,占全部醫療器械注冊數量的25.1%。
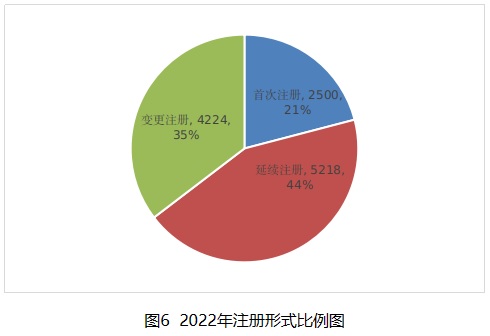
按照注冊形式區分,首次注冊2500項,占全部醫療器械注冊數量的20.9%;延續注冊5218項,占全部醫療器械注冊數量的43.7%;變更注冊4224項,占全部醫療器械注冊數量的35.4%。注冊形式比例情況見圖6。
(二)分項情況
1.境內第三類醫療器械注冊審批情況
境內第三類醫療器械注冊5692項。其中,醫療器械4209項,體外診斷試劑1483項。
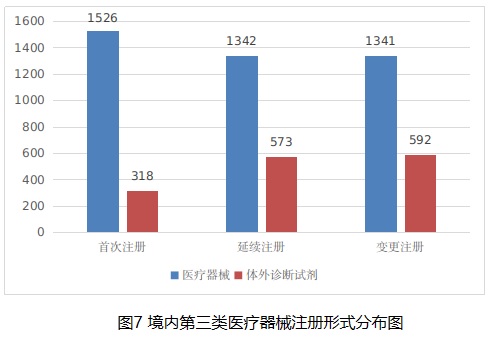
從注冊形式看,首次注冊1844項,占全部境內第三類醫療器械注冊數量的32.4%,延續注冊1915項,占全部境內第三類醫療器械注冊數量的33.6%;許可事項變更注冊1933項,占全部境內第三類醫療器械注冊數量的34%。注冊形式分布情況見圖7。
2.進口第二類醫療器械注冊審批情況
進口第二類醫療器械注2985項。其中,醫療器械注冊1908項,體外診斷試劑注冊1077項。
從注冊形式看,首次注冊309項,占全部進口第二類醫療器械注冊數量的10.4%;延續注冊1761項,占全部進口第二類醫療器械注冊數量的56.9%;許可事項變更注冊1003項,占全部進口第二類醫療器械注冊數量的32.8%。注冊形式分布情況見圖8。
3.進口第三類醫療器械注冊審批情況
進口第三類醫療器械注冊3265項。其中,醫療器械注冊2825項,體外診斷試劑注冊440項。
從注冊形式看,首次注冊347項,占全部進口第三類醫療器械注冊數量的10.6%;延續注冊1606項,占全部進口第三類醫療器械注冊數量的49.2%;許變更注冊1312項,占全部進口第三類醫療器械注冊數量的40.2%。
(三)首次注冊項目月度審批情況
2022年,國家藥監局共批準醫療器械首次注冊2500項,月度審批情況見圖10。
(四)具體批準品種種類分析
注冊的境內第三類醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中18個子目錄的產品。
注冊數量前五位的境內第三類醫療器械是:無源植入器械,神經和心血管手術器械,注輸、護理和防護器械,醫用成像器械,有源手術器械。與2021年相比,神經和心血管手術器械注冊產品數量超過注輸、護理和防護器械,且相同類別注冊數量均有大幅增加,其中有源手術器械增加76.6%,醫用成像器械增加78%,神經和心血管手術器械增加92.2%,無源植入器械增加68.4%。
注冊的進口醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中22個子目錄的產品。
注冊數量前五位的進口醫療器械,主要是:醫用成像器械,無源植入器械,注輸、護理和防護器械,口腔科器械,神經和心血管手術器械。與2021年相比,注輸、護理和防護器械類產品取代眼科器械,相同類別產品注冊數量略有增加。
(五)進口醫療器械國別情況
2022年,共有28個國家(地區)產品在我國獲批上市。
其中,美國、德國、日本、韓國、法國醫療器械在中國醫療器械進口產品首次注冊數量排前5位,注冊產品數量約占2022年進口產品首次注冊總數量的76.4%,與2021年相比略有增加。
從進口醫療器械代理人分布看,共有18個省涉及有本省企業作為進口醫療器械代理人,其中上海市代理人代理的進口首次醫療器械數量最多,占全部進口醫療器械數量的62.4%。
(六)境內第三類醫療器械省份分析
從2022年境內第三類醫療器械注冊情況看,相關注冊人主要集中在沿海經濟較發達省份。
其中,江蘇、廣東、北京、上海、浙江是境內第三類醫療器械首次注冊數量排前五名的省份,占2022年境內第三類醫療器械首次注冊數量的69.7%,與2021年相比增加1.8%。
