定制式義齒注冊產品是齒科器械中的明星產品之一,在臨床上廣泛使用。定制式義齒在我國屬于第二類醫療器械注冊產品,需要通過醫療器械注冊技術審評和醫療器械注冊質量管理體系核查方可取得醫療器械注冊證。本文為大家帶來上海市2023年度定制式義齒現場檢查問題匯總及分析,一起來學習。
定制式義齒注冊產品是齒科器械中的明星產品之一,在臨床上廣泛使用。定制式義齒在我國屬于第二類醫療器械注冊產品,需要通過醫療器械注冊技術審評和醫療器械注冊質量管理體系核查方可取得醫療器械注冊證。本文為大家帶來上海市2023年度定制式義齒現場檢查問題匯總及分析,一起來學習。
上海市2023年度定制式義齒現場檢查問題匯總及分析
1、年度檢查概況
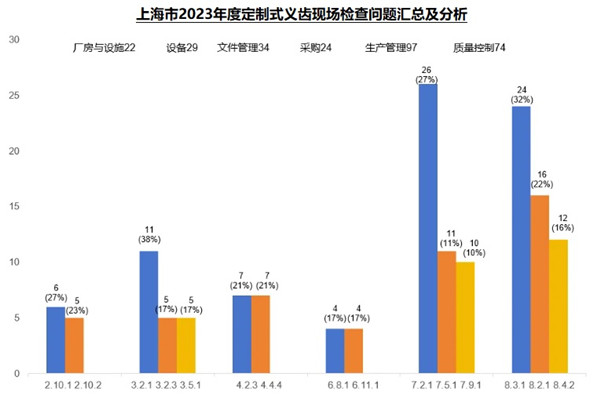
2023年度,本市定制式義齒現場核查合計發現缺陷409項。廠房與設施(22項次)、設備(29項次)、文件管理(34項次)、采購(24項次)、生產管理(97項次)、質量控制(74項次)占比超八成,下面將對這六個方面的關鍵風險點及常見核查問題進行梳理分析。
2、現場核查常見問題
下面將從廠房和人員、設備、文件管理、采購、生產管理、質量控制四個方面對無菌醫療器械的常見核查問題進行梳理分析。
2.1 廠房和人員
2.10.1 倉儲區應當能夠滿足原材料、包裝材料、中間品、產品等儲存條件和要求。
原料存儲溫度和要求不一致;未提供溫濕度控制要求;未制定已領用原材料使用后結存物料的管控要求。
2.10.2 倉儲區應當按照待驗、合格、不合格、退貨或召回等驚醒有序、分區存放各類材料和產品,便于檢查和監控。
缺少物料標簽,領用記錄;物料放置的區域不合理,例如不合格品區放置部分暫存品。
2.2 設備
3.2.1 生產設備的設計、選型、安裝、維修和維護應當符合預定用途,便于操作、清潔和維護。
未提供設備驗證報告或未完成。
3.2.2 生產設備應當有明顯的狀態標識,預防非預期使用。
生產設備無狀態標識;企業未建立相關的管理制度。
3.2.3 應當建立主要生產設備使用、清潔、維護和維修的操作規程,并保存相應的設備操作記錄。
設備無編號,無操作規程,無保養規程。
3.5.1 計量器具的量程精度應當滿足使用要求,計量器具應當標明其校準的有效期,保存相應記錄。
計量器具未進行校準或無法提供校準證書,例如溫度計未進行校準。
2.3 文件管理
4.2.3 文件更新或者修訂式應當按照規定評審和批準 ,能夠識別文件的更改和修訂狀態。
1)文件內容不一致,例如《消毒作業指導書》規定口腔石膏模型為紫外線臭氧消毒30分鐘,現場查見《作業環境和產品清潔、消毒規定》中,消毒45分鐘。
2)無法識別文件的更改或修訂狀態,例如作業文件未見文件標題,版本號,批準時間等信息;未能提供文件修訂相應的批準審核記錄。
4.2.4 分發和使用的文件應當為適宜文本,已撤銷或作廢的文件應當進行標識,防止誤用。
技術文件上沒有受控章;同一版文件內容不同。
4.3.1 應當確認作廢的技術文件等必要的質量管理體系文件的保存期限,滿足產品維修和產品質量責任追溯等需要。
未規定作廢的質量管理體系文件的保存期限。
4.4.1 應當建立記錄控制程序,包括記錄的 標識、保管、檢索、保存期限和處置要求等。
企業現采用某義齒軟件系統進行生產、檢驗過程的記錄管理,未制定電子記錄的管控要求。
4.4.4 記錄不得隨意涂改或銷毀,更改記錄應當簽注姓名和日期,并使原有信息仍清洗可辨,必要時,應當說明更改理由。
生產記錄存在涂改情況且無簽名;培訓日期隨意涂改且無涂改人員簽字。
2.4 采購
6.2.1 生產按照第二類醫療器械注冊的定制式義齒,應當采購經食品藥品監督管理部門批準注冊或備案的義齒原材料,其技術指標應當符合強制性標準或經注冊或備案的產品技術要求。
采購控制程序中未包含供應商再評價要求;現場未能提供原材料清單。
6.5.1 應當根據采購物品對產品的影響,確定對采購物品實行控制的方式和程度。
原材料清單未查見活動義齒所用原材料信息;未對采購物品進行分級分類管理。
6.7.1 應當與主要原材料商簽訂質量協議,明確雙方所承擔的質量責任。
質量協議中未明確采購產品的注冊信息及要求;未與主要原材料供方簽訂質量協議。
6.8.1 采購時應當明確采購信息,清晰表述采購要求,包括采購物品類別、驗收準則,規格型號,規程、圖樣等內容。
質量協議或采購合同中未明確原料采購信息,如生產廠商和注冊證號;質量協議中未明確物料名稱、規格型號、技術指標等。
6.11.1 應當制定口腔印模,口腔模型,口腔掃描數據及設計單的接受準測。
企業未制定口腔掃描數據的接收準則;口腔掃描數據未賦批號,僅有患者姓名,與其內部批號管理要求不一致。
2.5 生產管理
7.2.1 應當編制生產工藝規程,作業指導書等,明確關鍵工序和特殊過程。
1)生產作業指導書關鍵數據缺失或者過于簡單,無法指導實際生產,例如關鍵工序為氧化鋯燒結,僅規定了氧化鋯結晶的最高溫度及時間,未對結晶過程中的升溫速率、保溫時間等參數作出規定。
2)生產方式為增材制造的企業,較為突出的共性問題是金屬粉末方面的,例如未明確鈦合金粉末的打印過程中新舊粉末添加比例、次數要求。
3)實際生產條件與技術文件規定不一致,例如金屬打印室的溫濕度與《車間溫濕度管理制度》要求不一致。
4)未明確活動義齒關鍵工藝、特殊過程。
7.3.1 應當明確口腔印模,口腔模型及成品的消毒方法,并按照要求進行消毒。
實際消毒方案與消毒作業指導書不一致。
7.5.1 生產過程中采用的計算機軟件對產品質量有影響的,應當進行驗證和確認。
軟件驗證報告測評人不會操作軟件;未提供軟件驗證方案或驗證記錄。
7.9.1 每個產品應當有生產記錄,并滿足追溯要求。
生產過程中時間邏輯錯誤,例如生產檢驗時間晚于生產記錄的批準審核時間;原材料的采購時間晚于生產驗證時間。
7.9.2 生產記錄應當包括所用的主要義齒原材料生產企業名稱、主要義齒原材料名稱產品名稱,金屬品牌型號、批號/編號、主要生產設備名稱或編號、操作人員等內容。
生產記錄記錄缺失是或者不完整,例如無生產設備編號;未提供物料平衡核查記錄。
2.6 質量控制
8.2.1 應當定期對檢驗儀器和設備進行校準或者檢定,并予以標識。
儀器校準范圍未包含該儀器的全部檢測范圍,常見的設備有數顯卡尺,測厚儀。
8.3.1 應當根據強制性標準以及經注冊或者備案的產品技術要求制定產品的檢驗規程,并出具相應的檢驗報告或證書。
1)檢驗作業指導書內容存在漏洞,例如定制式活動義齒成品檢驗規程未明確激光熔鑄義齒表面粗糙度、尺寸等項目的檢驗規則。
2)檢驗機構承檢資質存在問題,例如生產廠家無法提供檢測機構的資質證明。
8.4.2 檢驗要求應當不低于強制性標準要求和國家有關產品的相關規定。
實際檢驗方式與檢驗作業指導書不一致,例如檢驗規程規定產品衛生指標為初始污染菌≤200cfu/g,產品技術要求中規定≤20cfu/g。
3、總結建議
綜合來看,定制式義齒現場檢查的共性問題主要集中在廠房與設施、設備、文件管理、采購、生產管理,質量控制等方面。其中增材制造企業金屬粉末的管理問題較為突出,在應用增材制造新技術的同時,生產企業和監管部門應當關注金屬粉末的管理等問題,保障公眾用械安全。
如有定制式義齒注冊咨詢,或是其他上海市第二類醫療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡,聯系人:葉工,電話:18058734169,微信同。