本文以上海市2023年度第二類體外診斷試劑注冊質(zhì)量管理體系核查數(shù)據(jù)為基礎說明,上海市器審中心依據(jù)《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》和《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄體外診斷試劑》對體外診斷試劑企業(yè)依申請開展現(xiàn)場核查,合計發(fā)現(xiàn)不符合項共666項次。從不符合項在《規(guī)范》中各章節(jié)的分布情況來看,設計開發(fā)(124項次)、采購控制(100項次)、生產(chǎn)管理(167項次)、質(zhì)量控制(138項次)占比近八成。
本文以上海市2023年度第二類體外診斷試劑注冊質(zhì)量管理體系核查數(shù)據(jù)為基礎說明,上海市器審中心依據(jù)《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》和《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范附錄體外診斷試劑》對體外診斷試劑企業(yè)依申請開展現(xiàn)場核查,合計發(fā)現(xiàn)不符合項共666項次。從不符合項在《規(guī)范》中各章節(jié)的分布情況來看,設計開發(fā)(124項次)、采購控制(100項次)、生產(chǎn)管理(167項次)、質(zhì)量控制(138項次)占比近八成。
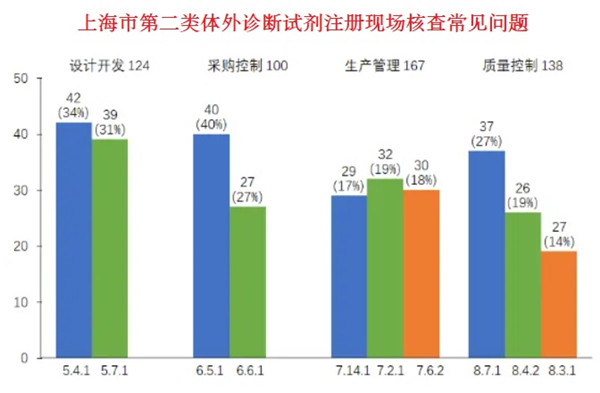
上海市第二類體外診斷試劑注冊現(xiàn)場核查常見問題
下面將從設計開發(fā)、采購控制、生產(chǎn)管理、質(zhì)量控制四個方面對體外診斷試劑產(chǎn)品的常見核查問題進行梳理分析。
1.第二類體外診斷試劑注冊產(chǎn)品設計開發(fā)
在設計開發(fā)方面,常見問題主要集中在條款*5.4.1和5.7.1。
*5.4.1設計和開發(fā)輸出應當滿足輸入要求,包括采購、生產(chǎn)和服務所需的相關信息,產(chǎn)品技術要求等。
(1)輸出不完整。
如工藝配方中投料量計算公式不完整;說明書中未明確樣本采樣管的類型;全血樣本未明確的抗凝劑種類;未明確樣本稀釋液種類。
(2)輸出內(nèi)容不一致。
如產(chǎn)品技術要求和標準操作規(guī)程中對抗原母液濃度標定的選用方法不一致。
5.7.1應當對設計和開發(fā)進行驗證,以確保設計和開發(fā)輸出滿足輸入的要求,并保持驗證結果和任何必要措施的記錄。
(3)驗證缺失、不完整。
如未驗證說明書中標識所用全部樣本類型;對校準品的適用機型驗證未覆蓋說明書中全部機型;驗證用樣本非說明書適用樣本類型。
2.采購控制
在采購控制方面,常見問題主要集中在條款6.5.1和6.6.1。
6.5.1采購時應當明確采購信息,清晰表述采購要求,包括采購物品類別、驗收準則、規(guī)格型號、規(guī)程、圖樣等內(nèi)容。
(1)質(zhì)量協(xié)議或采購要求內(nèi)容不完整。
如抗原抗體類原材料未明確生物學來源及克隆號信息;未明確抗體類型、生產(chǎn)廠家、純度等信息。
(2)采購要求和產(chǎn)品技術要求等文件的規(guī)定不一致。
如引物探針類原材料驗收標準和采購要求不一致。
6.6.1應當對采購物品進行檢驗或驗證,確保滿足生產(chǎn)要求。
(3)進貨檢驗記錄不完整。
如未記錄檢驗用設備和試劑信息;未記錄原始檢測值,無法體現(xiàn)檢測過程。
3.第二類體外診斷試劑注冊產(chǎn)品生產(chǎn)管理
在生產(chǎn)管理方面,常見問題主要集中在條款*7.2.1、7.14.1和7.6.2。
*7.2.1 應當編制生產(chǎn)工藝規(guī)程、作業(yè)指導書等,明確關鍵工序和特殊過程。
(1)工藝作業(yè)指導書未明確某些工藝參數(shù)。
如凍干作業(yè)指導書未明確溫度、時間和真空度等參數(shù);未明確引物原料的投料濃度。
(2)對關鍵工序和特殊過程的重要參數(shù)缺少驗證或確認。
如未對烘干箱和干燥箱的最大干燥數(shù)量進行驗證。
7.14.1 應當按照物料的性狀和儲存要求進行分類存放管理,應當明確規(guī)定中間品的儲存條件和期限。
(3)未規(guī)定中間品的儲存條件、效期,或未按規(guī)定執(zhí)行。
如未規(guī)定中間品凍融次數(shù)要求;實際生產(chǎn)使用了超過有效期的中間品。
7.6.2 生產(chǎn)記錄應當包括:產(chǎn)品名稱、規(guī)格型號、原材料批號、生產(chǎn)批號或生產(chǎn)編號、生產(chǎn)日期、數(shù)量、主要設備、工藝參數(shù)、操作人員等內(nèi)容。
(4)生產(chǎn)記錄信息不完整,不滿足可追溯要求。
如溶液配制記錄未正確記錄配制物料名稱與數(shù)量;未按工藝規(guī)程要求記錄穩(wěn)定時間與平衡時間及各階段產(chǎn)出的產(chǎn)物的數(shù)量;未記錄設備編號。
4.第二類體外診斷試劑注冊產(chǎn)品質(zhì)量控制
在質(zhì)量控制方面,常見問題主要集中在條款*8.3.1、8.4.2和8.7.1。
*8.3.1 應當根據(jù)強制性標準以及經(jīng)注冊或者備案的產(chǎn)品技術要求制定產(chǎn)品的檢驗規(guī)程,并出具相應的檢驗報告或證書。
(1)檢驗規(guī)程缺失具體的檢測項目,或檢驗規(guī)則不完整,不能有效指導操作。
如檢測項目未覆蓋強制性標準和產(chǎn)品技術要求;未制定批間差、穩(wěn)定性項目的檢驗規(guī)則。
(2)未按規(guī)程執(zhí)行檢驗。
如未按規(guī)定頻次實施檢測;未按規(guī)定數(shù)量進行測試。
8.4.2 檢驗記錄應當包括進貨檢驗、過程檢驗和成品檢驗的檢驗記錄、檢驗報告或證書等。
(3)檢驗記錄信息不完整,不滿足可追溯要求。
如未記錄檢驗設備編號;未記錄樣本信息;未記錄樣本配制過程;未記錄原始檢測數(shù)據(jù)。
8.7.1應當建立校準品、參考品量值溯源程序。對每批生產(chǎn)的校準品、參考品進行賦值。
(4)未制定企業(yè)參考品、工作校準品量值溯源程序;配制記錄與規(guī)程不完全一致;配制記錄不完整、缺失,不滿足可追溯要求。
如未記錄賦值用試劑的批號信息、未記錄國家參考品稀釋度;制備用臨床樣本無法有效追溯。
醫(yī)療器械質(zhì)量體系管理是實現(xiàn)對醫(yī)療器械生產(chǎn)全過程控制,保障醫(yī)療器械安全有效的重要手段。通過對現(xiàn)場核查常見不符合項的匯總分析,建議企業(yè)在日常質(zhì)量體系運行過程中,應確保各階段程序受控、分工職責明確、過程完整、內(nèi)容真實、記錄可追溯,落實產(chǎn)品質(zhì)量主體責任。
如有上海市第二類體外診斷試劑注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡,聯(lián)系人:葉工,電話:18058734169,微信同。