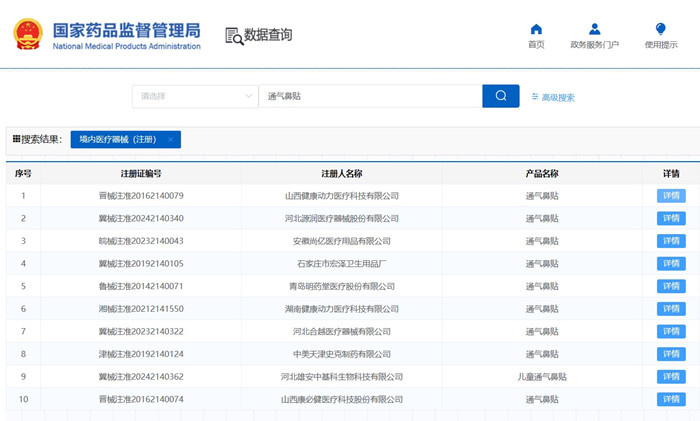
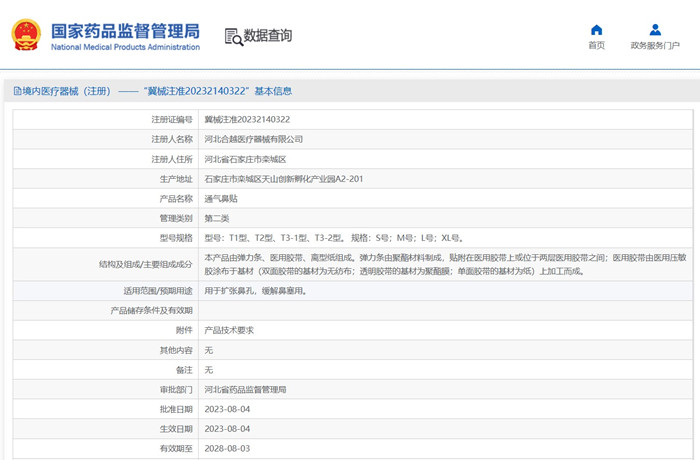
?用于擴張鼻孔,緩解鼻塞用的通氣鼻貼在我國屬于第二類醫(yī)療器械注冊產(chǎn)品。近日,國家藥監(jiān)局發(fā)布《通氣鼻貼注冊審查指導原則(征求意見稿)》,本文為大家介紹通氣鼻貼產(chǎn)品技術要求及醫(yī)療器械注冊審查要點,一起看正文。
用于擴張鼻孔,緩解鼻塞用的通氣鼻貼在我國屬于第二類醫(yī)療器械注冊產(chǎn)品。近日,國家藥監(jiān)局發(fā)布《通氣鼻貼注冊審查指導原則(征求意見稿)》,本文為大家介紹通氣鼻貼產(chǎn)品技術要求及醫(yī)療器械注冊審查要點,一起看正文。
一、通氣鼻貼產(chǎn)品結(jié)構(gòu)組成與工作原理
1.通氣鼻貼產(chǎn)品的結(jié)構(gòu)和組成
通氣鼻貼產(chǎn)品通常由表面材料、醫(yī)用壓敏膠、彈性片、基本材料、離型紙組成,不含藥。
2.通氣鼻貼產(chǎn)品工作原理
通氣鼻貼將具有彈性的塑料片通過強力膠和基布固定在鼻梁部位,供擴張鼻孔,輔助緩解鼻塞用。
二、通氣鼻貼產(chǎn)品技術要求及檢驗報告
產(chǎn)品技術要求的制定應符合《醫(yī)療器械產(chǎn)品技術要求編寫指導原則》的要求。申請人應依據(jù)產(chǎn)品的技術特征和臨床使用情況來確定產(chǎn)品安全有效的技術指標和檢驗方法。本指導原則給出通氣鼻貼需要考慮的產(chǎn)品基本技術性能指標,申請人根據(jù)自身產(chǎn)品的技術特點和用途制定相應的性能指標,且性能指標不得低于強制性國家標準、行業(yè)標準。
2.1產(chǎn)品型號/規(guī)格及其劃分說明
明確產(chǎn)品型號/規(guī)格,闡明各型號/規(guī)格間的區(qū)別及劃分說明,型號/規(guī)格的表述應與全部注冊申報資料保持一致,并提供結(jié)構(gòu)示意圖。
2.2性能指標
通氣鼻貼產(chǎn)品性能指標至少應包括以下幾點:
2.2.1外觀及尺寸;
2.2.2剝離強度;
2.2.3持粘性;
2.2.4剝離殘留物;
2.2.5彈性片彈性及持續(xù)時間;
2.2.6無菌(如適用);
2.2.7微生物限度(如適用);
2.2.8化學性能;
根據(jù)不同材料特性,由企業(yè)決定具體的化學性能要求(如:酸堿度等,具體指標的選擇可以參照相應的國家、行業(yè)標準及已上市同類產(chǎn)品情況)。用環(huán)氧乙烷滅菌的產(chǎn)品應規(guī)定環(huán)氧乙烷殘留量的要求。
2.2.9根據(jù)產(chǎn)品宣稱的技術特點制定的其他性能要求。
2.3檢驗報告
2.3.1同一注冊單元內(nèi)所檢驗的產(chǎn)品應當是能夠代表本注冊單元內(nèi)其他產(chǎn)品安全性和有效性的典型產(chǎn)品,其功能最齊全、或結(jié)構(gòu)最復雜、或風險最高。其他型號可進行差異性檢測。
2.3.2典型產(chǎn)品的確定可以通過比較同一注冊單元內(nèi)所有產(chǎn)品的技術結(jié)構(gòu)、性能指標等相應資料,說明其能夠代表本注冊單元內(nèi)其他產(chǎn)品的安全性和有效性。
三、通氣鼻貼注冊審查要點
3.1通氣鼻貼生物學特性研究
按照GB/T 16886.1《醫(yī)療器械生物學評價第1部分:風險管理過程中的評價與試驗》、《關于印發(fā)醫(yī)療器械生物學評價和審查指南的通知》要求開展生物相容性評價,生物相容性評價研究資料應當包括:生物相容性評價的依據(jù)、項目和方法;產(chǎn)品所用材料的描述及與人體接觸的性質(zhì)和時間;實施或豁免生物學試驗的理由和論證;對于現(xiàn)有數(shù)據(jù)或試驗結(jié)果的評價。
本指導原則中的通氣鼻貼屬于與完好皮膚長期接觸(>24小時,≤30天)的表面接觸器械,開展生物學評價,應按照GB/T 16886.1《醫(yī)療器械生物學評價第1部分:風險管理過程中的評價與試驗》標準進行評價,至少應包括細胞毒性、刺激反應、致敏反應等。
3.2通氣鼻貼滅菌工藝研究
如產(chǎn)品無菌供應,應明確滅菌工藝(方法和參數(shù))及其選擇依據(jù)和無菌保證水平(SAL),并提供滅菌確認報告,無菌保證水平(SAL)應保證達到1×10-6。滅菌過程的選擇應至少考慮以下因素:產(chǎn)品與滅菌過程的適應性;包裝材料與滅菌過程的適應性;滅菌對產(chǎn)品安全有效性的影響。
若滅菌使用的方法容易出現(xiàn)殘留,如環(huán)氧乙烷滅菌,應當明確殘留物信息及采取的處理方法,并提供環(huán)氧乙烷解析的研究資料。
如有通氣鼻貼注冊或其它醫(yī)療器械注冊咨詢服務需求,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡,聯(lián)系人:葉工,電話:18058734169,微信同。