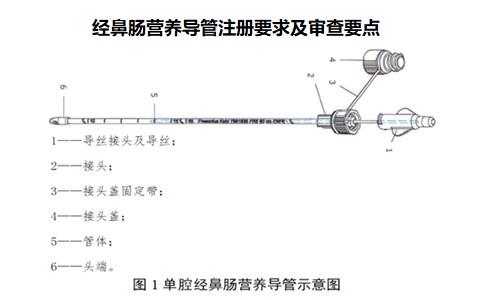
經鼻腸營養導管注冊產品可采用TPU、聚氯乙烯、硅橡膠等材料制成,目前已上市產品常用材料為TPU。通常由頭端、管體、接頭、接頭蓋、導絲等組成。根據產品結構可分為單腔、雙腔、三腔等,頭端可有直插型、螺旋型、重力型、球囊等不同設計;接口有扣蓋,有利于保持清潔;外壁帶有數字刻度,可有效指示產品在體內的使用長度;管壁使用射線可探測材料,具有顯影定位功能。
經鼻腸營養導管注冊產品可采用TPU、聚氯乙烯、硅橡膠等材料制成,目前已上市產品常用材料為TPU。通常由頭端、管體、接頭、接頭蓋、導絲等組成。根據產品結構可分為單腔、雙腔、三腔等,頭端可有直插型、螺旋型、重力型、球囊等不同設計;接口有扣蓋,有利于保持清潔;外壁帶有數字刻度,可有效指示產品在體內的使用長度;管壁使用射線可探測材料,具有顯影定位功能。
經鼻腸營養導管通常由鼻腔經食道插入胃,在胃腸蠕動的推動下滑移進入十二指腸或空腸內,或借助胃鏡/十二指腸鏡輔助插入十二指腸或空腸,并經X射線顯影等方式確定置管位置,與相關給營養器械配合,用于向胃腸道引入營養液等,部分多腔鼻腸管還可用于胃部沖洗等。
1.經鼻腸營養導管注冊產品的適用范圍、禁忌證
1.1適用范圍
醫療器械注冊申請人應當明確產品的適用范圍,其描述應與申報產品的性能、功能相符,并應與臨床評價資料結論一致。如:用于經鼻向胃腸道引入營養液等。部分可實現沖洗等其他輔助功能。
1.2預期使用環境
明確該產品預期使用的地點,如醫療機構等。可能影響其安全性和有效性的環境條件,如溫度、濕度、壓力、海拔等。1.3適用人群
適用人群建議說明目標患者人群信息,患者選擇標準,重要考慮因素等。
1.4禁忌證:產品材料有過敏史者,食道下段靜脈曲張患者、食道出血患者、食道梗阻患者、腸道吸收障礙患者等其他不宜采用經鼻腸營養管飼的患者。
2.經鼻腸營養導管注冊產品技術要求及檢驗報告
2.1經鼻腸營養導管注冊產品技術要求
應當按照《醫療器械產品技術要求編寫指導原則》的規定編制產品技術要求,技術指標引用標準應當為現行有效版本。
經鼻腸營養導管基本技術性能指標包括但不限于以下內容,申請人可根據產品自身特點,參考相應的國家、行業標準制定產品技術要求,如有不適用條款(包括國家標準、行業標準要求),申請人應在申報資料中說明理由。
2.1.1外觀 :經鼻腸營養導管應清潔、無異物,不應有表面缺陷和加工缺陷;導絲頭端應圓鈍。
2.1.2尺寸:外徑、內徑、長度及允差等。
應給出產品的示意圖。
2.1.3連接件(拉伸性能、液體泄漏)
應符合YY 0483要求。
2.1.4拉伸性能:應符合YY 0483要求。
2.1.5管身刻度的要求。
2.1.6抗彎曲性能。
2.1.7配合性能。
2.1.8耐腐蝕性(若適用)。
2.1.9化學性能。
根據不同材料特性,由企業決定具體的化學性能要求(如:酸堿度、紫外吸光度、還原物質、蒸發殘渣、重金屬、過氧化物等,具體指標的選擇可以參照相應的國家、行業標準及已上市同類產品情況)。用環氧乙烷滅菌的產品應規定環氧乙烷殘留量的要求。
2.1.10射線可探測性(也可使用其他定位方式,如:電磁導航等)。
2.1.11產品應無菌。
2.1.12根據產品宣稱的技術特點制定的其他性能要求。
耐壓性(若適用);
涂層(若適用):摩擦力等;
帶球囊的產品應符合YY/T 0817要求。
2.2經鼻腸營養導管注冊產品檢驗報告
提供檢驗樣品型號/規格的選擇依據。所檢驗型號/規格需為能夠代表本注冊單元內其他型號/規格的典型產品。當申報產品包括多個型號規格,需綜合考慮經鼻腸營養導管的原材料、結構組成、包裝方式、滅菌方式、生產工藝和預期用途等影響因素。一個型號不能完全覆蓋時,應選擇其他型號進行相關性能的補充性檢測。注意典型型號/規格不一定是臨床常用型號/規格。