經(jīng)鼻膽汁外引流管在我國屬于第二類醫(yī)療器械注冊產(chǎn)品,通常由管體和接頭組成,有的根據(jù)需要配有鼻轉(zhuǎn)換管、連接管或三通閥、矯直管等。產(chǎn)品與內(nèi)窺鏡配合使用,通過口鼻進入膽管,用于膽汁引流,屬于一次性使用無菌產(chǎn)品。
經(jīng)鼻膽汁外引流管在我國屬于第二類醫(yī)療器械注冊產(chǎn)品,通常由管體和接頭組成,有的根據(jù)需要配有鼻轉(zhuǎn)換管、連接管或三通閥、矯直管等。產(chǎn)品與內(nèi)窺鏡配合使用,通過口鼻進入膽管,用于膽汁引流,屬于一次性使用無菌產(chǎn)品。
經(jīng)鼻膽汁外引流管注冊要求及審查要點:
1.醫(yī)療器械注冊單元劃分
根據(jù)《醫(yī)療器械分類目錄》,經(jīng)鼻膽汁外引流管,分類編碼為14注輸、護理和防護器械-05非血管內(nèi)導(dǎo)(插)管-06引流導(dǎo)管。
按照《醫(yī)療器械注冊單元劃分指導(dǎo)原則》,注冊單元劃分著重考慮產(chǎn)品的技術(shù)原理、結(jié)構(gòu)組成、性能指標(biāo)及適用范圍等因素。
對于配合使用、以完成同一手術(shù)/護理目的的工具組合可以作為同一注冊單元進行申報。引流管(含接頭)、連接管、鼻轉(zhuǎn)換管可作為經(jīng)鼻膽汁外引流管的組成進行申報。
產(chǎn)品結(jié)構(gòu)組成不同而導(dǎo)致產(chǎn)品性能指標(biāo)不同時,原則上劃分為不同注冊單元,如新型的結(jié)構(gòu)設(shè)計和本指導(dǎo)原則中提及的傳統(tǒng)結(jié)構(gòu)設(shè)計不宜放在同一注冊單元。
2.產(chǎn)品的適用范圍/預(yù)期用途、禁忌證
產(chǎn)品的適用范圍應(yīng)與申報產(chǎn)品的性能、功能相符。
適用范圍:
產(chǎn)品與內(nèi)窺鏡配合使用,經(jīng)過鼻腔進行膽汁的引流。
禁忌證同經(jīng)內(nèi)鏡鼻膽管引流術(shù)(ENBD)的禁忌證。
3.產(chǎn)品技術(shù)要求
根據(jù)產(chǎn)品的主要功能和預(yù)期用途,產(chǎn)品的技術(shù)指標(biāo)主要包括產(chǎn)品的外觀、尺寸、物理性能、化學(xué)性能和無菌性能。不同企業(yè)的產(chǎn)品參數(shù)根據(jù)設(shè)計要求可有所區(qū)別,并可根據(jù)自身產(chǎn)品的技術(shù)特點制訂性能指標(biāo)要求,但不得低于相關(guān)強制性國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)的要求。
3.1形狀尺寸要求
3.1.1外觀:引流管(尤其是頭端)的相關(guān)要求。
3.1.2尺寸及形狀
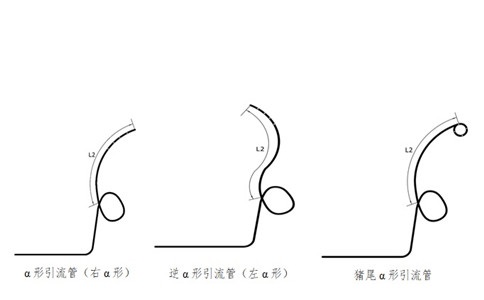
建議應(yīng)給出引流管及組件的示意圖。
3.1.2.1引流管的外徑、內(nèi)徑、總長度、遠(yuǎn)端長度(L2)、固定圈形狀要求。
3.1.2.2經(jīng)鼻管的外徑和長度。
3.2物理性能
3.2.1射線可探測性(如適用)
如果生產(chǎn)商標(biāo)示射線可探測,應(yīng)能提供相應(yīng)的試驗證據(jù)。
3.2.2抗彎曲性
引流管的管體在彎曲狀態(tài)下是否可靠支撐引流的完成(待相關(guān)行業(yè)標(biāo)準(zhǔn)發(fā)布后參照執(zhí)行)。
3.2.3抗變形(適用于連接負(fù)壓泵的產(chǎn)品)
預(yù)期在負(fù)壓使用下的任何組件,在生產(chǎn)商標(biāo)稱的最大負(fù)壓下應(yīng)無明顯影響其功能的變形。
3.2.4無泄漏
引流管或任何組件在生產(chǎn)商標(biāo)稱的最大負(fù)壓下應(yīng)無泄漏。
3.2.5斷裂力
3.2.5.1連接器
連接器的定義參照GB/T 15812.1《非血管內(nèi)導(dǎo)管第1部分:一般性能試驗方法》附錄F的規(guī)定:即按照制造商的說明,需要裝配的連接器。
連接器的最小斷裂力不小于制造商的聲稱值,建議不低于YY 0489《一次性使用無菌引流導(dǎo)管及輔助器械》的相關(guān)規(guī)定,否則應(yīng)提交充分的驗證資料證明產(chǎn)品的安全有效性。
3.2.5.2引流導(dǎo)管和其他組件部分
引流導(dǎo)管和其他組件部分的定義參照GB/T 15812.1《非血管內(nèi)導(dǎo)管第1部分:一般性能試驗方法》附錄B的規(guī)定:即產(chǎn)品中各管狀部分、各座或連接器與管路的各連接處、以及不同管路的各連接處。
引流導(dǎo)管和其他組件部分的最小斷裂力不小于制造商的聲稱值,建議不低于YY 0489《一次性使用無菌引流導(dǎo)管及輔助器械》的相關(guān)規(guī)定,否則應(yīng)提交充分的驗證資料證明產(chǎn)品的安全有效性。
3.2.6流量
按照GB/T 15812.1《非血管內(nèi)導(dǎo)管第1部分:一般性能試驗方法》附錄E進行試驗,流量應(yīng)不小于制造商的聲稱值。
3.2.7魯爾接頭(若適用)
應(yīng)符合GB/T 1962.1《注射器、注射針及其他醫(yī)療器械6%(魯爾)圓錐接頭 第1部分:通用要求》、GB/T 1962.2《注射器、注射針及其他醫(yī)療器械6%(魯爾)圓錐接頭 第2部分:鎖定接頭》的要求。
3.2.8配合性能(若適用)
引流管與鼻轉(zhuǎn)換管的配合性能應(yīng)予以要求。
3.2.9導(dǎo)絲通暢性
從外引流管遠(yuǎn)端插入導(dǎo)絲(導(dǎo)絲直徑由企業(yè)制訂),導(dǎo)絲在引流管內(nèi)應(yīng)穿行順滑,無明顯阻滯現(xiàn)象。
3.3化學(xué)指標(biāo)
3.3.1環(huán)氧乙烷殘留量
3.3.2根據(jù)不同材料特性,參照GB/T 14233.1《醫(yī)用輸液、輸血、注射器具檢驗方法第1部分:化學(xué)分析方法》,由企業(yè)決定對化學(xué)性能提出要求項目,至少應(yīng)包括還原物質(zhì)、酸堿度、重金屬總含量、蒸發(fā)殘渣。
3.4無菌性能:以滅菌包裝提供的產(chǎn)品應(yīng)無菌。