脊柱后路內固定系統注冊產品是臨床常見的植入類醫療器械,通常由純鈦及鈦合金材料、聚醚醚酮、鈷鉻鉬合金、不銹鋼等材料制成。本文為大家介紹脊柱后路內固定系統產品技術要求及主要性能指標,供醫療器械注冊人參考。
脊柱后路內固定系統注冊產品是臨床常見的植入類醫療器械,脊柱融合為目的脊柱后路內固定系統,通常包含金屬脊柱棒、固定板、椎弓根螺釘、橫向連接件、椎板鉤、緊固器、連接器、墊片等組件,也適用于變徑棒(金屬)、雙棒椎弓根螺釘、聚醚醚酮脊柱棒、可注射骨水泥的椎弓根螺釘、表面噴涂羥基磷灰石涂層的椎弓根螺釘等產品。通常由純鈦及鈦合金材料、聚醚醚酮、鈷鉻鉬合金、不銹鋼等材料制成。本文為大家介紹脊柱后路內固定系統產品技術要求及主要性能指標,供醫療器械注冊人參考。
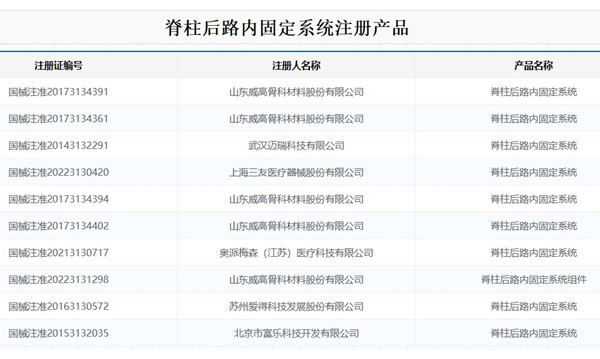
1.脊柱后路內固定系統適用范圍
適用范圍的表述需客觀、清晰,使用有明確定義或行業公認的術語或名詞。例如:與同一系統組件配合,適用于胸腰椎脊柱后路內固定。對于不同設計類型的組件(如可注射骨水泥的椎弓根螺釘等)的適應證不同的情形,可在適用范圍中明確產品具體的適應證。
2.脊柱后路內固定系統注冊單元劃分
產品注冊單元的劃分需符合《醫療器械注冊單元劃分指導原則》的要求。脊柱后路內固定系統可按照實現某種臨床預期用途的產品組合劃分注冊單元,亦可以組件作為注冊單元進行申報。
2.1若按照系統進行申報,需根據產品預期實現的某種臨床預期用途,將產品劃分為如下注冊單元:頸椎后路釘棒內固定系統、頸椎后路釘板內固定系統、胸腰椎后路釘棒內固定系統、枕頸胸釘板棒內固定系統。
2.2若以同一系統內單個或多個組件(如脊柱棒、椎弓根螺釘等)為注冊單元進行申報,需明確與該產品配合的組件名稱、組成系統后的預期適用范圍和適應證等。
2.3材質不同(包括材料牌號不同)的同類組件需劃分為不同的注冊單元,作為單一整體組配或組合使用的組件可以按同一注冊單元申報,如有涂層時,涂層材料差異亦需考慮。如:不同材質的脊柱棒作為不同的注冊單元申報;作為同一系統組件配合使用的、材質已確定且唯一的組件,如脊柱棒(CoCrMo合金)、椎弓根螺釘(Ti6Al4V鈦合金)、頂絲(純鈦),雖組件間材質不同,但因組合使用,可作為同一注冊單元申報。
2.4主要制造工藝方法不同(如經注塑或機加工的聚醚醚酮脊柱棒)的同類組件,需劃分為不同注冊單元。
3.脊柱后路內固定系統產品技術要求和主要性能指標
產品技術要求的制定需符合《醫療器械產品技術要求編寫指導原則》的要求,同時結合產品具體適用的指導原則或相關國家標準、行業標準(可參考YY/T 0119《脊柱植入物 脊柱內固定系統部件》系列標準的相關要求)以及產品的特點,選擇適用項對各項性能指標和檢驗方法進行制定,以保證產品安全、有效、質量可控。
3.1產品型號/規格及其劃分說明
明確產品型號/規格,闡明各型號/規格間的區別及劃分說明,型號/規格的表述需在全部注冊申報資料中保持一致。
3.2性能指標
產品技術要求中指標需針對終產品,選取適用的項目制定,且性能指標不低于產品適用的強制性國家標準和強制性行業標準。如產品有特定設計,注冊申請人還需根據產品設計特征設定相應的性能指標,并將其列入產品技術要求。對于可進行客觀判定的成品定性或定量的功能性、安全性指標,需將其列入產品技術要求。
3.2.1外觀
3.2.2不銹鋼產品的耐腐蝕性能(如適用)
3.2.3硬度
3.2.4表面缺陷
3.2.5表面粗糙度(如有涂層,需明確涂層表面粗糙度)
3.2.6關鍵尺寸及公差
3.2.7羥基磷灰石涂層表面形貌(如適用,需明確厚度、孔隙率、平均孔隙截距)
3.2.8羥基磷灰石涂層靜態力學性能(如適用)
3.2.9配合性能(如適用,單個組件申報時不適用)
3.2.10脊柱棒、橫向連接件的抗拉強度(如適用)
3.2.11無菌(如適用)
3.2.12環氧乙烷殘留量(如適用)
3.3檢驗方法
產品的檢驗方法需根據技術性能指標設定,檢驗方法需優先采用國家標準/行業標準中的方法。對于相關國家標準/行業標準中不適用的條款,需說明不適用的原因。所有引用的標準注明其編號、年號或版本號。自建檢驗方法需提供相應的方法學依據及理論基礎,同時保證檢驗方法具有可操作性和可重現性,必要時可以采用相應圖示進行說明,文本較大的可以附錄形式提供。
3.4附錄
建議注冊申請人以附錄形式明確產品的結構圖示、產品金屬材料信息(如化學成分、顯微組織、內部質量、力學性能等)和聚醚醚酮材料的理化性能和紅外光譜,同時明確上述材料性能符合的相關標準。對于羥基磷灰石涂層,明確材料的鈣磷原子比、結晶相含量、微量元素含量。表面經陽極氧化處理的產品需明確其表面元素信息。如已開展磁共振(MR)環境下的行為屬性的相關驗證,磁共振兼容性相關信息需在附錄中明示。
3.5其他
如有不適用的項目,需予以說明。本部分僅提供了常規產品的基本性能要求,給予參考。
對于使用新材料、新技術、新設計或具有新作用機理、新功能的產品,需在產品技術要求中明確產品所具的有其他功能性、安全性指標,性能指標的制定需符合《醫療器械產品技術要求編寫指導原則》的要求。