為加強醫療器械注冊工作的監督和指導,進一步提高注冊審查質量���,國家食品藥品監督管理總局組織制定了《眼科飛秒激光治療機注冊技術審查指導原則》,2018年03月20日發布。
為加強醫療器械注冊工作的監督和指導�����,進一步提高注冊審查質量����,國家食品藥品監督管理總局組織制定了《眼科飛秒激光治療機注冊技術審查指導原則》,2018年03月20日發布。
眼科飛秒激光治療機注冊技術審查指導原則
本指導原則旨在指導注冊申請人對眼科飛秒激光治療機注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。
本指導原則是對眼科飛秒激光治療機的一般要求�����,申請人應依據產品的具體特性確定其中內容是否適用���,若不適用�����,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化�。
本指導原則是供申請人和審查人員使用的指導文件����,不涉及注冊審批等行政事項�����,亦不作為法規強制執行�,如有能夠滿足法規要求的其他方法�,也可以采用,但應提供詳細的研究資料和驗證資料�����。應在遵循相關法規的前提下使用本指導原則����。
本指導原則是在現行法規、標準體系及當前認知水平下制定的����,隨著法規�����、標準體系的不斷完善和科學技術的不斷發展,本指導原則相關內容也將適時進行調整�����。
一�����、適用范圍
本指導原則適用于角膜及晶狀體等相關手術飛秒激光治療機。
眼科的其他應用可參照本指導原則中的要求準備注冊資料�����。
二���、注冊單元劃分
根據《醫療器械注冊管理辦法》(國家食品藥品監督管理總局令第4號)第七十四條:“醫療器械注冊或者備案單元原則上以產品的技術原理�����、結構組成�����、性能指標和適用范圍為劃分依據�?���!毖劭骑w秒激光治療機的注冊單元劃分應當遵守以下基本原則:
與主機無任何物理或電氣連接的附件應與主機劃分為不同的注冊單元。例如����,與眼科飛秒激光治療機主機無任何連接的開瞼器����、注射器應與主機劃分為不同的注冊單元���。
適用范圍不同的眼科飛秒激光治療機應劃分為不同的注冊單元�。例如,用于屈光手術的治療機與用于白內障手術的治療機劃分為不同的注冊單元�����。
手術方式不同應劃分為不同的注冊單元�。例如�����,用于LASIK手術中制作角膜瓣的飛秒激光治療機與能獨自完成屈光手術的全飛秒激光治療機劃分為不同的注冊單元���。
三����、綜述資料
(一)產品描述
1.根據產品自身結構特點闡述各關鍵組件的工作原理���。例如�,飛秒激光發生的原理、光束傳輸及控制的原理。明確飛秒激光的激光物質�����、激光放大方式�。描述患者接口組件的固定方式及原因。OCT或者生物測量組件的工作原理?����?山Y合光路圖和/或結構圖進行說明�����。
產品工作原理可根據產品實際研發情況進行描述����,例如:飛秒激光是指脈沖寬度為10-15秒量級的激光脈沖�,由于激光脈沖持續的時間非常短�,與生物組織相互作用時幾乎沒有熱效應破壞組織結構,可以實現非常精準細微的切割�����。眼科手術的飛秒激光一般需要高重復頻率如幾百kHz����,平均功率為瓦量級,脈沖寬度為百飛秒量級的激光參數�,要獲得這種參數的飛秒激光首先需要一個飛秒種子光源����。飛秒種子光源是由飛秒振蕩器通過鎖模實現的����,根據不同增益晶體采用不同的鎖模方式,比較常見的有Kerr透鏡鎖模�����,SESAM可飽和介質鎖模,非線性偏振態變化鎖模等�。飛秒種子源的能量都非常低����,必須將飛秒種子源進行放大后才能使用�����,飛秒激光的放大方式是以啁啾脈沖放大技術(Chirped -Pulse Amplification�����,簡稱CPA)為基礎����,其工作原理是:首先由振蕩器產生穩定的鎖模脈沖序列,隨后通過脈沖展寬器���,在盡可能維持光譜成分不變的情況下,使種子脈沖展寬到數百皮秒使其峰值功率大幅度降低�,這樣當展寬后的脈沖進入放大器放大時���,可以有效地降低種子脈沖的增益飽和效應并避免因過高峰值功率而引起的非線性效應和對材料的損傷�����,從而保證了能量的穩定增長及高效率放大,最后采用具有與展寬器色散相反的再壓縮系統����,使脈沖復原到與種子相近的時間寬度�����,進而得到高峰值功率的飛秒激光脈沖。根據啁啾脈沖放大技術原理�����,飛秒激光器主要結構包括飛秒脈沖振蕩器�����、脈沖展寬器����、能量放大器�、脈沖壓縮器�����,以及電子同步選單器等部分�。
飛秒激光原理如圖1�����。
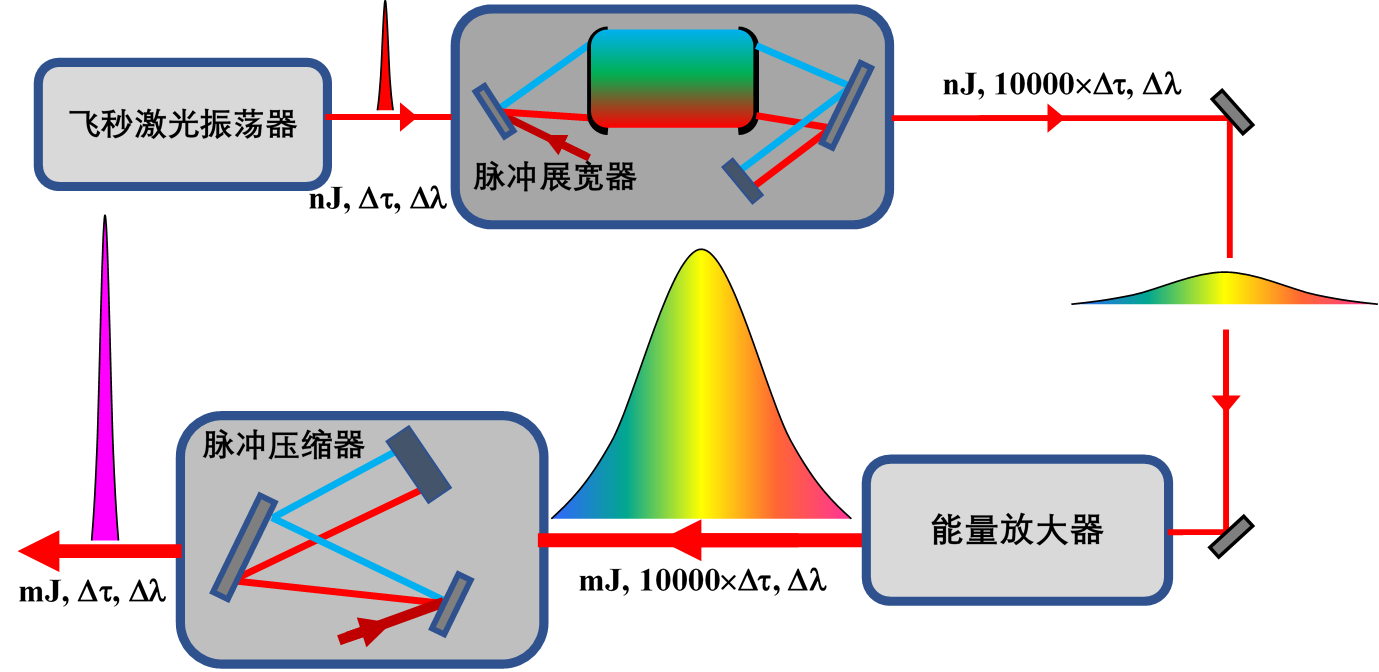
圖1 飛秒激光原理
2.作用機理詳述飛秒激光與生物組織(角膜�����、晶狀體前囊膜、晶狀體核)相互作用的機理及量效關系。
3.結構組成應詳述主機���、患者接口組件、OCT或其他生物測量裝置(若有)、顯示屏�、腳踏開關的結構�,并提供相應組成部分的圖片�����。詳述主機內部的結構�,明確飛秒激光器(含冷卻系統)、光束傳輸部件�、光束掃描控制部件����、輔助光源(如�,照明、固視�、成像等)的結構�����。
描述產品的物理尺寸�、重量、型號等信息。
對于多種型號規格的產品應列表和/或提供圖示說明各型號之間的異同。
提供整機的電路框圖�����,包括激光電源的總體電路框圖及各單元模塊的電路框圖�����,簡述各模塊的主要功能及相互關系�。
4.描述產品功能及其組成部件(關鍵組件和軟件)的功能����。例如,制作角膜瓣����、制作角膜切口�、晶狀體前囊撕開�����、晶狀體核劈碎(對應的關鍵組件)等���。描述OCT等測量裝置所能測量的數據類型���。描述軟件可實現的主要功能�����,例如,激光掃描方式、制作圖形�����。
5.區別于其他同類產品的特征���。描述關鍵組件及功能與其他同類產品的區別����。例如����,激光發射的控制方式、角膜瓣結構�、激光掃描方式�、劈裂晶狀體核的方式����、照明系統、生物測量裝置等�。
產品組成示例:
本產品由主機���、患者接口組件�、OCT�����、顯示屏����、腳踏開關、患者床組成����。主機包含飛秒激光器���、光束傳輸部件、光束掃描控制部件���、輔助光源。
(二)包裝說明
提供整機的外包裝及內部各組件的包裝情況����。提供一次性使用無菌手術包與滅菌方法相適應的最初包裝的信息�。
(三)適用范圍和禁忌癥
1.適用范圍
應當明確產品在醫療機構使用�����;明確目標用戶及其操作該產品應當具備的技能/知識/培訓���。
應明確用于屈光手術還是用于白內障手術�。明確各種功能所對應的適應癥�。例如,在白內障手術中制作角膜切口的功能����,是用于植入晶體還是用于輔助前囊膜撕開����。
適用范圍示例:
在醫療機構中由經培訓的專業醫師使用�����,用于LASIK手術制作角膜瓣����,制作植入物用的囊袋����,板層角膜移植���。在移除晶狀體的白內障手術中����,用于前囊膜撕開和晶狀體核劈碎。
2.適用人群:目標患者人群的信息���,患者選擇標準的信息,以及使用過程中需要監測的參數、考慮的因素�。例如�����,目標患者人群為年齡≥18歲的成人。
3.禁忌癥
應當按適應癥明確說明眼科飛秒激光治療機不適宜應用的某些疾病、情況或特定的人群。
示例:
進行LASIK手術制作角膜瓣的禁忌癥包括:角膜疾病或病理阻礙激光傳輸,或使激光發生畸變�;低眼壓或高眼壓�����;青光眼;存在角膜植入物;患者接受后續治療后預期的殘余必要的角膜基質厚度過?����?���;圓錐角膜。
進行晶狀體前囊膜撕開和晶狀體核劈碎的禁忌癥包括:角膜疾病或病理阻礙激光傳輸,或使激光發生畸變;角膜結構異常����;屈光介質嚴重混濁�����;低眼壓或高眼壓;存在角膜植入物;瞳孔異常�����。
(四)參考產品
如有申報產品的同類產品和/或前代產品����,應說明相關的背景情況,提供同類產品和/或前代產品的上市情況。應當詳細說明申報產品與前代產品的異同點�,對比主要功能�����、關鍵激光參數及完成相應功能的特征參數之間的異同。
四、研究資料
(一)產品性能研究
1.著重從機理方面說明激光波長����、能量�����、脈寬、重復頻率等性能指標設定的原因及依據,并提供激光輸出的波形圖���。
2.詳述掃描方式、光斑大小�����、光斑間距設定的原因及依據�。
3.詳述選用OCT或其他生物測量裝置的原因,并提供其關鍵性能參數設定的依據�����。
4.詳述照明���、固視及瞄準光系統的波段����、照射方式����、功率或能量大小設定的原因及依據。提供光輻射安全的研究資料���,可提供ISO 15004—2《眼科儀器 基本要求和試驗方法 第2部分:光危害防護》的檢測報告(可以是自檢報告、委托檢驗報告或注冊檢驗報告����,也可以是境外檢測報告)���,或者其他可證明光輻射對于人眼安全的研究資料�����。
5.患者接口組件的固定方式(負壓吸引、壓平)�、材料(折射率)選用的原因及依據�。
6.如適用的國家標準���、行業標準中有不采納的條款����,應說明不適用的理由。
(二)生物相容性評價研究
應說明產品預期與角膜接觸的組件���,提交與角膜接觸的材料清單���。
生物學評價應根據產品與人體接觸部位���、接觸方式及接觸時間�����,按GB/T 16886.1標準的規定要求進行評價����。并注意:
1.生物相容性評價應對與人體接觸的成品而不是原材料進行評價。
2.研究資料中的生物學試驗報告可提供境內檢驗報告或境外檢驗報告�����,檢驗報告中應包括樣品制備方法�、試驗方法及試驗結果。境內檢驗報告可以是委托檢驗���,檢測機構可以不同于全性能的檢測機構,但須在有醫療器械檢驗資質的機構檢驗�����;境外報告需提供國外實驗室表明其符合GLP實驗室要求的質量保證文件�。
(三)滅菌/消毒工藝研究
患者接口組件通常為一次性使用無菌產品。申請人應明確滅菌工藝(方法和參數)和無菌保證水平(SAL)�����,并提供滅菌確認報告���。如滅菌使用的方法容易出現殘留�,應當明確殘留物信息及采取的處理方法�����,并提供研究資料�?��?蓞⒖糋B 18279《醫療器械 環氧乙烷滅菌確認和常規控制》�、GB 18280《醫療保健產品滅菌確認和常規控制要求》等。
(四)軟件研究
眼科飛秒激光治療機軟件一般用來控制眼科飛秒激光治療機的運行,包括各項參數的控制、監測和提示,其軟件安全性級別應歸為C級�����。
申請人應當依照法規和《醫療器械軟件注冊技術審查指導原則》(國家食品藥品監督管理總局通告2015年第50號)的要求�,提供醫療器械軟件描述文檔。
(五)其他研究資料
證明產品安全性、有效性的其他研究資料����。
1.說明飛秒激光制瓣過程中負壓吸引的壓力范圍�����,脫負壓的安全處理方法。
2.說明產品是否具有安全保護設置或程序�。
3.說明激光與物質的作用過程中可能出現的現象�,激光切割的組織的光滑程度���。
4.說明激光是否容易穿透上皮或深層組織���,對周邊組織可能的影響����,激光作用后是否有炎癥反應的出現。
5.說明不同邊緣切割方式下,制作出的角膜瓣存在的潛在風險,并提供支持性資料����。
6.白內障手術(除后囊距離外,劈核���、撕囊)的風險點。
五�、臨床評價資料
申請人應當依據所申報產品的結構組成�、性能參數和預期用途等�,按照《醫療器械臨床評價技術指導原則》(國家食品藥品監督管理總局通告2015年第14號)的要求,提供相應的臨床評價資料�。進口產品還應提供境外政府醫療器械主管部門批準該產品上市時的臨床評價資料�。
六�、產品風險分析資料
應按照YY/T 0316—2016《醫療器械 風險管理對醫療器械的應用》的要求,針對眼科飛秒激光治療機的安全特征���,從能量危害、生物學和化學危害�����、操作危害、信息危害等方面���,對產品風險進行全面分析并闡述相應的防范措施,風險管理報告及相關資料的要求可參考附1�����。
七���、產品技術要求
應當按照《醫療器械產品技術要求編寫指導原則》(國家食品藥品監督管理總局通告2014年第9號)編制產品技術要求���。應在產品技術要求中明確軟件發布版本和軟件完整版本號的命名規則�����。
產品技術要求應給出需要考慮的主要技術指標�,若申報產品有其他功能�,申請人應采用相應的標準或結合自身技術能力自行確定該功能的定性定量要求����。
產品技術要求及相關資料的要求可參考附2。
八�����、注冊檢驗及檢驗產品的典型性
(一)典型產品的確定原則
1.典型產品應是同一注冊單元內能夠代表本單元內其他產品安全性和有效性的產品���。
2.建議考慮功能最齊全�����、結構最復雜����、風險最高的產品����。
3.注冊單元內各種產品的主要安全指標、性能指標或功能不能被某一產品全部涵蓋時���,則應選擇涵蓋安全指標、性能指標和功能最多的產品作為典型產品���。
(二)電磁兼容檢驗要求
1.應符合YY 0505《醫用電氣設備 第1—2部分:安全通用要求 并列標準:電磁兼容 要求和試驗》中規定的要求。
2.基本性能
至少包含治療激光輸出功率的準確性�,和主要功能無非預期的輸出或模式的改變(例如���,顯示����、測量及控制部件是否正常工作)���。
3.電磁兼容性試驗要求
提供測試模式選擇依據�,基本性能選擇依據�����,檢品典型性的選擇依據�。對于缺少必要的理論和/或試驗數據作為依據的情況�,電磁兼容檢驗應當涵蓋申報單元中的全部型號。
4.應體現GB 9706.1《醫用電氣設備第1部分:安全通用要求》與YY 0505《醫用電氣設備 第1—2部分:安全通用要求 并列標準:電磁兼容 要求和試驗》檢驗報告之間的關聯性。
九�����、說明書和標簽
(一)說明書
1.說明書應包含所有規格型號的信息����。治療機與一次性患者接口組件可分別提供說明書也可提供總的說明書。
2.說明書應當符合《醫療器械說明書和標簽管理規定》(國家食品藥品監督管理總局令第6號)、GB 9706.1《醫用電氣設備 第1部分:安全通用要求》���、YY 0505《醫用電氣設備 第1—2部分:安全通用要求 并列標準:電磁兼容 要求和試驗》����、GB 9706.20《醫用電氣設備 第2部分:診斷和治療激光設備安全專用要求》����、GB 7247.1《激光產品的安全 第1部分:設備分類、要求和用戶指南》等相關標準中的要求�,至少應包含以下內容:
(1)產品型號規格及功能�。
(2)產品的適用范圍及適應癥�。明確患者的年齡,屈光手術可治療的球鏡和柱鏡度數范圍(如適用)���。
(3)產品的禁忌癥。
(4)產品安裝和使用說明或者圖示�。
(5)符合ISO 15004—2的相關內容。
(6)設備的基本參數說明,包括電氣和性能����。相關內容應與產品技術要求�、檢驗報告等其他注冊資料一致�。
(7)生產日期,使用期限或者失效日期;運輸���、儲存條件。
(8)警告、注意事項等內容,包括但不限于:
a.眼科飛秒激光治療機使用資質的要求����,如只能由經過培訓的專業的醫務人員操作���。
b.電磁兼容方面相關的警告及措施���。
c.眼科飛秒激光治療機不應放置在影響眼科飛秒激光治療機運行和性能的位置的警告�����。
d.應給出清洗與消毒、滅菌的說明。
e.對于一次性使用的附件或部件,應有不可重復使用的警告。
f.對檢修人員�����、銷售商及相關人員�,應提供說明如何檢修產品的調整裝置及其工作過程。
(二)標簽
應當符合《醫療器械說明書和標簽管理規定》(國家食品藥品監督管理總局令第6號)。醫療器械標簽因位置或者大小受限而無法全部標明上述內容的,至少應當標注產品名稱����、型號�����、規格、生產日期和使用期限或者失效日期���,并在標簽中明確“其他內容詳見說明書”�����。
十����、編寫單位
國家食品藥品監督管理總局醫療器械技術審評中心���。
附1
眼科飛秒激光治療機產品風險分析資料要求
產品風險分析資料是對產品的風險管理過程及其評審的結果予以記錄所形成的資料���。
眼科飛秒激光治療機的設計應能夠保證����,當單個元件、部分或軟件發生故障時�����,不會引起不能接受的危害�����。應對由單個故障條件引起的����,并與設備各功能有關的危害加以識別。對于每種危害�,其產生傷害的可能性都應進行評估�,要考慮各種危害控制����,以及對各故障條件引起的傷害可能性進行評估�。
一、眼科飛秒激光治療機在設計開發中的風險管理
(一)在眼科飛秒激光治療機設計開發的可行性評審階段�,應對眼科飛秒激光治療機所有的可能的風險進行識別�����,并初步擬定風險控制措施。該階段的風險分析結果需作為產品設計輸入的一部分���。
該階段風險識別的方法是:
1.根據眼科飛秒激光治療機的預期用途和安全性特征,識別出可能的風險�����。
2.分析在正常和故障兩種條件下���,與眼科飛秒激光治療機有關的已知或可預見的危害處境����,估計每個危害處境的風險。
3.分析眼科飛秒激光治療機的可能生物學危害���,并評估它的風險。
(二)在眼科飛秒激光治療機的系統架構評審�,或者是設計開發圖紙評審階段����,應進行風險管理活動�����。該階段風險管理的方法可以采用FMEA(Failure Mode and Effect Analysis)�、FMECA(failure mode effect and criticality analysis)�、FTA(fault tree analysis)���、HAZOP(Hazard and Operability Analysis)或者HACCP(Hazard Analysis Critical Control Point)的方法����,針對設計零件或系統模塊可能產生的風險進行分析。
二、眼科飛秒激光治療機在生產中的風險管理
在眼科飛秒激光治療機的生產工藝評審階段�,應進行風險管理活動����。該階段風險管理的方法可以采用PFMEA(Process Failure Mode and Effect Analysis)�、PHA、FTA、HAZOP或者HACCP的方法,從產品的生產工藝流程,對于每一加工步驟���,列出可能的故障模式并分析它們對患者或操作者的危害。
三、與眼科飛秒激光治療機相關的風險
注冊申請人應分析可能導致產品風險的硬件/組件���、軟件可能的故障模式,對眼科飛秒激光治療機的可能出現的風險進行判別,并制定解決的措施�。以下是對眼科飛秒激光治療機可能風險的舉例但并不受以下內容的限制:激光輸出的脈寬�、重復頻率波動�、激光波長、帶寬等超出允差范圍;激光能量超過預期的激光分類限值����;冷卻系統失靈導致系統過熱或損壞諧振腔�;由于諧振腔失效導致激光輸出異常�����、產生非預期伴隨輻射或無輸出���;由于鎖模失效導致激光輸出的脈寬����、重復頻率異常����;腳踏開關、控制器、緊急停止裝置失效導致系統失控����;激光傳輸系統故障導致激光輸出能量低于允差���,或改變模式和發散角�����;真空吸附等配合手術用器械不能有效固定患者。
四、與眼科飛秒激光治療機相關的潛在危害
以下列出了眼科飛秒激光治療機常見的潛在危害���,但并不受以下危害的限制:
(一)產品產生的能量危害
如:電能,過高的漏電流會對患者產生危害;熱能���,引起人體組織過熱或導致燒傷;電磁場,向外輻射的電磁場影響其他醫療器械�;激光���,對眼睛���、皮膚或其他組織造成光生物危害如熱傷害�、光化學傷害等�,或發生錯誤的激光輸出或切削。
(二)由使用產品引起的生物危害
如:應用部分消毒滅菌不當導致患者感染或死亡���;接觸患者的材料不滿足生物相容性;手術過程對組織造成的非預期損傷���;由于廢物或裝置處置引起的污染等。
(三)工作/儲存環境引起的危害
如:由于靜電放電引起眼科飛秒激光治療機故障導致患者損傷;電磁干擾和環境應力會導致眼科飛秒激光治療機的控制器�、腳踏開關�����、緊急停止裝置出現非預期的啟動或停止����;冷卻系統在低溫下發生結冰和膨脹導致損壞;光學器件發生冷凝現象導致激光輸出異常����;因碰撞����、墜落���、或振動引起的意外機械損傷���。
(四)與使用裝置相關的危害
如:錯誤操作���;標簽不足或不正確�����;技術規范不完善����;警告信息不全或不恰當�;與成功完成預定的醫療手術所必要的其他裝置、產品等不兼容等����。
(五)由于裝置維護和老化引起的危害
如:激光傳輸系統、光學元件�、諧振腔受到污染�����、劣化�、損壞等�����,導致激光能量輸出異常����、發生伴隨輻射等危害�����。
下表為眼科飛秒激光治療機治療機常見危害舉例�,供參考����,申請人應根據申報產品具體預期用途和與安全性有關特征編寫風險管理報告。
表1 眼科飛秒激光治療機危害示例
危害分類 | 危害二級分類 | 危害示例 |
能量危害 | 電磁能 | 使用環境內其他設備對眼科飛秒激光治療機電磁干擾導致電氣設備非控制啟動或輸出參數(如激光能量)非預期增加����。 |
使用環境內其他設備對眼科飛秒激光治療機電磁干擾導致激光束聚焦位置的錯誤���。 |
輻射能 | 不正確的輸出(如非預期的激光輸出)導致皮膚或眼睛損傷 |
熱能 | 散熱條件變差引起組件著火危險�,或冷卻系統失效導致設備無法正常工作�。 |
機械能 | 設備重心不穩導致設備的傾倒。 |
設備的機械振動導致激光束聚焦位置錯誤����。 |
設備固定裝置松動�,造成患者接口組件脫落�����,對患者的傷害。 |
凸緣或機架的邊緣和毛刺,對患者和操作者造成傷害。 |
生物學和化學危害 | 生物學危害 | 設備材料用錯,或無菌包裝失效�,造成眼睛傷害�����。 |
…… | …… | …… |
五、風險估計
應識別可能造成危害處境的合理可預見的事件序列或組合,并列明造成的危害處境�����。
對應每個判定的危害處境�,應利用可以得到的資料或數據估計其相關的一個或多個風險。對危害發生概率不能加以估計的危害處境,編寫一個危害的可能后果的清單,以便于風險評價和風險控制���。
對損害發生的概率和損害的嚴重度進行定性或定量的估計。
下表為治療眼科飛秒激光治療機常見危害���、可預見的事件序列、危害處境和損害之間的關系舉例�,供參考���。
表2 眼科飛秒激光治療機危害���、可預見的事件序列�����、危害處境和損害
之間的關系示例
危害 | 可預見的事件序列 | 危害處境 | 損害 |
電磁能 (網電源) | 使用環境內其他設備對眼科飛秒激光治療機電磁干擾導致電氣設備非控制啟動或輸出參數(如激光能量)非預期增加,或使用環境內其他設備對眼科飛秒激光治療機電磁干擾導致激光束聚焦位置的錯誤。 | (1)設備輸出強度意外增加�。 (2)激光束聚焦位置錯誤���。 | 影響治療效果或傷害患者。 |
電磁能 (靜電釋放ESD) | 靜電釋放造成控制部件(如觸摸屏)失效�����,激光輸出非預期終止 | (1)設備死機���。 (2)激光輸出非預期終止�����。 | 影響治療效果或傷害患者����。 |
生物學的 (微生物污染) | 無菌包裝失效,造成眼睛傷害�。 | 設備非無菌 | 眼部感染 |
功能 (沒有輸出) | (1)光路控制失效�����。 (2)控制電路失效。 (3)冷卻系統故障。 (4)腳踏開關故障����。 (5)緊急停止裝置故障�����。 | 設備無輸出 | 無法治療或治療不完整 |
…… | …… | …… | …… |
六、風險評價
對每個已判定的危害處境,注冊申請人應依據風險管理計劃中制定的風險可接受準則進行風險評價,決定是否需要降低風險�����。
風險評價的結果記入風險管理文件中���。
七�、風險控制
注冊申請人應對經風險評價后不可接受的或考慮可進一步采取措施降低的風險制定適當的風險控制措施(一個或多個)�����,把風險降低到可接受的水平�����。
在制定降低風險的控制措施方案時,應充分考慮產品國家標準���、行業標準中有關降低風險的措施。
應確保降低風險的控制措施在研制初期得到有效的輸入���,對每項風險控制措施實施予以驗證,并應對措施的有效性實施驗證�����。
注冊申請人應對采取降低風險的控制措施后的剩余風險以及是否會引發新的風險進行評價����。
以上降低風險的控制措施、控制措施的驗證����、剩余風險評價等信息可以記入風險管理報告中���。
八�����、綜合剩余風險的可接受性評價
注冊申請人應對綜合剩余風險是否可接受給出結論性意見���,并對運用恰當的方法獲得與本產品相關的生產信息與臨床應用的信息進行闡述并做出承諾����。
風險管理報告應由最高管理者(法人代表)或其授權的代表簽字批準。
附2
眼科飛秒激光治療機產品技術要求
本部分內容給出需要考慮的產品主要技術指標,如有其他附加功能����,注冊申請人應根據產品性能結構特點����,參考相應的國家標準�����、行業標準�����,增加相關要求����。
一�����、產品型號/規格及其劃分說明
存在多種型號的�����,應明確不同型號之間的異同�。若含有軟件,應明確軟件發布版本和軟件完整版本號的命名規則。
二�����、性能指標
性能指標中須對所有組成部件(例如����,手術顯微鏡、OCT等)的主要功能做出要求,同時還應對飛秒激光的性能參數和手術質量分別做出要求。
(一)激光性能要求
1.激光中心波長�,允差±10nm����,可略寬���。
2.治療激光模式:基膜����。
3.治療激光脈沖能量及范圍。
4.治療激光最大輸出平均功率。
5.脈沖寬度�。
6.脈沖重復頻率�����。
7.治療激光聚焦光斑直徑。
8.出窗數值孔徑或終端發散角。
9.治療激光的光斑點間距�。
10.治療激光的光斑行間距�。
11.治療激光輸出功率不穩定度���。
12.治療激光輸出功率復現性�����。
14.治療激光對準角膜上的預期點的偏差����。
(二)手術質量要求
手術質量的要求可根據申報的具體適應癥做出相應要求����。要求如下:
1.制瓣
角膜瓣厚度����,允差±15μm;角膜瓣直徑�;角膜瓣的留蒂寬度(或角度)���;角膜瓣的邊緣切割角度���;瓣蒂位置(若有)�;瓣的形狀(若有)�;瓣的創面質量:角膜瓣或分離上皮瓣的創面應平整光滑無殘留,均勻一致�,不允許有碎瓣�����。
2.前囊切開(撕開)
切割直徑、切割深度�����。
3.晶狀體核劈碎
激光劈核(劈核形狀);激光碎核(螺旋)(若適用���,根據實際情況進行要求):碎核內半徑、碎核間隙z軸�����、碎核(柱狀切削)半徑�����、碎核(徑向切削)半徑;與后囊膜的距離(測量設備的要求)�。
4.角膜切口
角膜切口寬度�����、入口角設置、出口角設置���、隧道長度。
5.角膜移植
切割厚度�,允差±20μm(離體切割厚度的允差由注冊申請人確定)�;切割直徑或切割寬度�;邊緣切割角度;切割形狀�。
(三)附件要求
1.治療包(或套件)要求
最大負壓�����、壓平力(參考行標);真空氣路要求����;尺寸�;無菌:患者接口裝置套件應無菌�;環氧乙烷殘留量:經環氧乙烷滅菌后,其殘留量應小于10μg/g����。
2.接觸鏡的要求
曲率����、中心厚度�、光透過率。
3.生物測量學性能(若適用)���,白內障手術
角膜曲率半徑測量允差�����、角膜中心厚度測量允差����、前房深度測量允差����、晶狀體頂點位置測量允差、晶狀體曲率半徑測量允差、晶狀體中心厚度測量允差����。
4.腳踏開關的要求:具體見相關標準�����。
(四)軟件功能要求
根據產品的實際情況編寫,例如:
飛秒激光掃描方式、掃描順序;3D眼球模擬重建功能����;系統開機自動檢測各項功能�����。
(五)患者支撐系統(床)要求
參考準分子激光標準,明確調節范圍�、旋轉角度(若有)和最大速度�。
(六)不間斷電源或其他保障措施(可不在產品組成中,但需有要求,在說明書中明確)
應明確電力不足時不間斷電源(UPS)可堅持的時間����。
(七)輔助光源(按功能提要求)
輔助光源包括照明�、固視和成像等(含OCT光源)所采用的所有光源�����。眼科光源設備可參考ISO 15004—2標準。注視燈(固視燈)應明確光譜范圍和功率。紅外成像燈應明確輻照度并增加成像功能的要求�。
(八)輔助設備要求(若適用)
1.手術顯微鏡:符合GB 11239.1—2005相關要求�。
2.裂隙照明性能:裂隙寬度�����、裂隙高度�、裂隙光斑的最大照度����、裂隙平行度,裂隙應左右移動,裂隙光斑邊緣整齊光滑�����,清晰分明����,亮度應均勻。
3.光學相干斷層掃描儀(OCT):光源的中心波長及帶寬�、最大輸出功率����、掃描寬度���、橫向(B-Scan)分辨率和縱向(A-Scan)分辨率���、掃描深度���、測量允差和測量重復性�、目標指示裝置(若適用)的放大率和視場中心的分辨力���。注明頻域還是時域���。
(九)安全
應符合GB 9706.1—2007����、GB 9706.20—2000、GB 7247.1—2012���、YY 0505—2012、GB 9706.15(若適用)的要求����。
(十)環境適應性
應符合GB/T 14710的要求����;注冊申請人應給出具體試驗條件和檢驗項目�����。但各試驗項目的“最后檢測”應至少包含“激光最大輸出平均功率”���。
三�、檢驗方法
在檢驗方法中應明確做試驗時的工作條件���。性能指標中的每條要求均應有相應的檢測方法�,并盡量保持檢驗方法中的編號與性能指標的編號對應。
需要特別說明的是���,“角膜瓣的厚度及厚度允差”的試驗方法,建議大�����、中���、小每種切割厚度至少選擇6只新鮮豬眼球�,制作出角膜瓣,并對每片角膜瓣的五點厚度用含有角膜測厚功能的裝置進行測量�����,從而計算出五點的角膜厚度的平均值���,即為該角膜瓣的厚度�。
四、附錄
提供產品安全特征�。
在附錄中增加申報設備的整體外觀圖及附件圖�,并提供飛秒激光輸出波形圖�����。