2023年10月23日,根據(jù)國(guó)家藥品監(jiān)督管理局2023年度醫(yī)療器械注冊(cè)審查指導(dǎo)原則制修訂計(jì)劃的有關(guān)要求,國(guó)家藥監(jiān)局器審中心組織編制了《牙科種植體(系統(tǒng))注冊(cè)審查指導(dǎo)原則(2023年修訂)》,詳見(jiàn)正文。
2023年10月23日,根據(jù)國(guó)家藥品監(jiān)督管理局2023年度醫(yī)療器械注冊(cè)審查指導(dǎo)原則制修訂計(jì)劃的有關(guān)要求,國(guó)家藥監(jiān)局器審中心組織編制了《牙科種植體(系統(tǒng))注冊(cè)審查指導(dǎo)原則(2023年修訂)》,詳見(jiàn)正文。
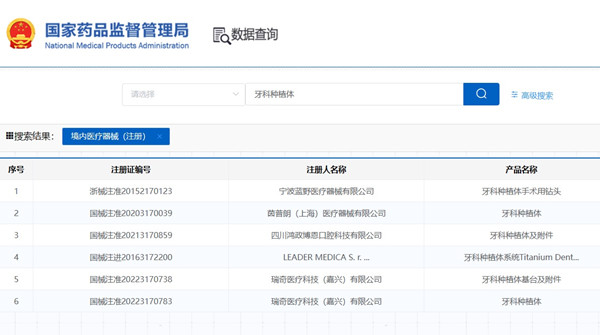
牙科種植體(系統(tǒng))注冊(cè)審查指導(dǎo)原則(2023年修訂版)(征求意見(jiàn)稿)
本指導(dǎo)原則旨在指導(dǎo)醫(yī)療器械注冊(cè)申請(qǐng)人對(duì)牙科種植體(系統(tǒng))注冊(cè)申報(bào)資料的準(zhǔn)備及撰寫(xiě),同時(shí)也為技術(shù)審評(píng)部門(mén)對(duì)注冊(cè)申報(bào)資料的審評(píng)提供技術(shù)參考。
本指導(dǎo)原則是對(duì)牙科種植體(系統(tǒng))注冊(cè)申報(bào)資料的一般要求,注冊(cè)申請(qǐng)人需依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用。若不適用,需具體闡述理由及相應(yīng)的科學(xué)依據(jù),并依據(jù)產(chǎn)品的具體特性對(duì)注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化。
本指導(dǎo)原則是供注冊(cè)申請(qǐng)人和技術(shù)審評(píng)人員的指導(dǎo)性文件,但不包括注冊(cè)審批所涉及的行政事項(xiàng),亦不作為法規(guī)強(qiáng)制執(zhí)行,需在遵循相關(guān)法規(guī)和強(qiáng)制性標(biāo)準(zhǔn)的前提下使用本指導(dǎo)原則。如果有能夠滿(mǎn)足相關(guān)法規(guī)要求的其他方法,也可以采用,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定的,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善,以及科學(xué)技術(shù)的不斷發(fā)展,本指導(dǎo)原則相關(guān)內(nèi)容也將進(jìn)行適時(shí)的調(diào)整。
一、適用范圍
本指導(dǎo)原則適用于經(jīng)外科手術(shù)后保留于口腔內(nèi)的牙科種植體(系統(tǒng))。不適用于定制式種植體(系統(tǒng))。對(duì)于改變適用范圍或具有全新的技術(shù)特性(如采用了全新的工作原理、材質(zhì)、結(jié)構(gòu)設(shè)計(jì)、表面處理、生產(chǎn)工藝)的可參照本指導(dǎo)原則適用部分。
二、注冊(cè)審查要點(diǎn)
注冊(cè)申報(bào)資料宜符合國(guó)家藥品監(jiān)督管理局《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》中的要求,同時(shí)宜符合以下要求:
(一)監(jiān)管信息
1.產(chǎn)品名稱(chēng)
產(chǎn)品的命名需采用《醫(yī)療器械分類(lèi)目錄》或國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)中的通用名稱(chēng),或以產(chǎn)品臨床預(yù)期用途、主體材質(zhì)、適用部位為依據(jù)命名,需符合《醫(yī)療器械通用名稱(chēng)命名規(guī)則》、《口腔科器械通用名稱(chēng)命名指導(dǎo)原則》等相關(guān)法規(guī)的要求。如牙種植體、牙種植體系統(tǒng)、鈦合金牙種植體等。
2.分類(lèi)編碼
根據(jù)《醫(yī)療器械分類(lèi)目錄》,分類(lèi)編碼為17-08-01,管理類(lèi)別為Ⅲ類(lèi)。
3.注冊(cè)單元?jiǎng)澐?/p>
產(chǎn)品注冊(cè)單元的劃分需符合《醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則》的要求。不同材質(zhì)的種植體宜劃分為不同的注冊(cè)單元,如陶瓷、金屬;不同結(jié)構(gòu)設(shè)計(jì)或不同工作原理的種植體需考慮劃分為不同的注冊(cè)單元,如骨水平、軟組織水平種植體宜劃分為不同注冊(cè)單元,穿顴種植體、常規(guī)種植體宜劃分為不同注冊(cè)單元;不同表面處理方式的種植體應(yīng)劃分為不同的注冊(cè)單元,如陽(yáng)極氧化、噴砂酸蝕。
4.結(jié)構(gòu)組成
需明確產(chǎn)品所有組件信息,需包括各組件基體材質(zhì)及符合的標(biāo)準(zhǔn)信息、涂層材質(zhì)信息(如適用)、表面處理信息、交付狀態(tài)、滅菌方式(如適用)、無(wú)菌有效期、一次性使用信息。
5.產(chǎn)品列表
需列表說(shuō)明申報(bào)產(chǎn)品所有組件各型號(hào)規(guī)格代號(hào)、結(jié)構(gòu)示意圖、外形尺寸、表面處理信息、交付狀態(tài)、組配使用信息。
(二)綜述資料
1.器械及操作原理描述
1.1需明確牙科種植體(系統(tǒng))中各組件信息,需包括各組件名稱(chēng)、配合使用信息、基體材料及符合標(biāo)準(zhǔn)信息、表面處理信息、涂層材料信息(如適用)。牙科種植體(系統(tǒng))一般包含種植體及覆蓋螺絲,需分別進(jìn)行描述。
1.2明確各型號(hào)產(chǎn)品的設(shè)計(jì)依據(jù)及劃分依據(jù),提供產(chǎn)品各型號(hào)的結(jié)構(gòu)示意圖,并充分描述產(chǎn)品結(jié)構(gòu)設(shè)計(jì)、尺寸公差、表面處理信息。
1.3提供產(chǎn)品工作原理/作用機(jī)理,明確申報(bào)產(chǎn)品配合使用器械、使用方法、臨床應(yīng)用方式,如種植類(lèi)型(即刻種植、延期種植)、修復(fù)類(lèi)型(單牙、多牙和全口修復(fù))等。
2.產(chǎn)品的適用范圍、適用人群、禁忌證
產(chǎn)品的適用范圍、適用人群、禁忌證需與申報(bào)產(chǎn)品的性能、功能相符。
2.1適用范圍:牙科種植體(系統(tǒng))一般用于通過(guò)外科手術(shù)方式將產(chǎn)品植入人體缺牙部位的上下頜牙槽骨內(nèi),用于為義齒等修復(fù)體提供固定或支撐,以恢復(fù)患者的咀嚼功能。對(duì)于特殊應(yīng)用情形的,如穿顴種植體需明確具體適用部位。
2.2預(yù)期使用環(huán)境
明確預(yù)期使用的地點(diǎn)(如醫(yī)療機(jī)構(gòu)),說(shuō)明可能影響其安全性和有效性的環(huán)境條件。
2.3適用人群
明確目標(biāo)患者人群信息、患者選擇標(biāo)準(zhǔn)信息以及明確使用過(guò)程中需要考慮的因素。
2.4禁忌證:如適用,通過(guò)風(fēng)險(xiǎn)/受益評(píng)估后,針對(duì)某些疾病、情況或特定的人群,認(rèn)為不推薦使用該產(chǎn)品,應(yīng)當(dāng)明確說(shuō)明,如成分過(guò)敏人群、患者生理?xiàng)l件(口腔情況、骨質(zhì)、骨量、使用牙位等)。
3.型號(hào)規(guī)格
需提供產(chǎn)品各型號(hào)規(guī)格的劃分原則。對(duì)于存在多種型號(hào)、規(guī)格的產(chǎn)品,需明確各型號(hào)、規(guī)格的區(qū)別。需采用對(duì)比表及帶有說(shuō)明性文字的圖片、圖表,對(duì)各種型號(hào)、規(guī)格的結(jié)構(gòu)組成、表面處理、結(jié)構(gòu)設(shè)計(jì)及尺寸信息、產(chǎn)品特征、性能指標(biāo)等方面加以描述。牙科種植體(系統(tǒng))中各組件需分別列表對(duì)上述內(nèi)容進(jìn)行說(shuō)明。
4.與同類(lèi)產(chǎn)品或前代產(chǎn)品的比較信息
需提供同類(lèi)產(chǎn)品(國(guó)內(nèi)外已上市)或前代產(chǎn)品(如有)的信息,闡述申請(qǐng)注冊(cè)產(chǎn)品的研發(fā)背景和目的。對(duì)于同類(lèi)產(chǎn)品,應(yīng)當(dāng)說(shuō)明選擇其作為研發(fā)參考的原因。
申請(qǐng)人需綜述同類(lèi)產(chǎn)品國(guó)內(nèi)外研究及臨床使用現(xiàn)狀及發(fā)展趨勢(shì)。列表比較說(shuō)明申報(bào)產(chǎn)品與參考產(chǎn)品(同類(lèi)產(chǎn)品或前代產(chǎn)品)在工作原理、結(jié)構(gòu)組成、制造材料、性能指標(biāo)、適用范圍、作用方式、應(yīng)用技術(shù)等方面的異同,性能指標(biāo)的對(duì)比應(yīng)重點(diǎn)關(guān)注牙科種植體(系統(tǒng))結(jié)構(gòu)設(shè)計(jì)、表面處理及表面形貌、牙科種植體(系統(tǒng))機(jī)械性能、尺寸及公差、骨結(jié)合及穩(wěn)定性能的對(duì)比。其中,結(jié)構(gòu)設(shè)計(jì)對(duì)比內(nèi)容,需就不同類(lèi)別的產(chǎn)品分別進(jìn)行對(duì)比,對(duì)于存在結(jié)構(gòu)差異的型號(hào)需就差異部分進(jìn)行說(shuō)明,對(duì)產(chǎn)品的結(jié)構(gòu)(包括外形、頸部、體部、根端等)、幾何尺寸、種植體-基臺(tái)連接及抗旋轉(zhuǎn)設(shè)計(jì)(如種植體外部/內(nèi)部六角特性、錐度等)、種植體軸向平面特性(如種植體表面凸凹、螺距、螺紋、種植體軸向抗旋轉(zhuǎn)溝槽)、穿齦及穿齦高度、平臺(tái)轉(zhuǎn)移等關(guān)鍵元素進(jìn)行對(duì)比。對(duì)于表面處理方式及表面形貌完全一致的,不需重復(fù)考慮骨結(jié)合及穩(wěn)定性能。明確產(chǎn)品有無(wú)使用新材料、新的活性成分、新技術(shù)、新設(shè)計(jì)或具有新作用機(jī)理、新功能。
5.包裝說(shuō)明
提供產(chǎn)品的包裝信息,包括包裝形式、包裝材料、包裝工藝。對(duì)于無(wú)菌醫(yī)療器械,需說(shuō)明其無(wú)菌屏障系統(tǒng)的信息;對(duì)于具有微生物限度要求的醫(yī)療器械,需說(shuō)明保持其微生物限度的包裝信息。說(shuō)明如何確保最終使用者可清晰地辨識(shí)包裝的完整性。對(duì)于含保存液包裝,需明確保存液信息,并考慮保存液與包材料的浸提情況、保存液在種植體表面沉淀情況。
6.申報(bào)產(chǎn)品上市歷史
如適用,提交申報(bào)產(chǎn)品在各國(guó)家或地區(qū)的上市批準(zhǔn)時(shí)間、銷(xiāo)售情況。如有不良事件和召回,分別對(duì)申報(bào)產(chǎn)品上市后發(fā)生的不良事件、召回的發(fā)生時(shí)間、申請(qǐng)人采取的處理和解決方案、相關(guān)部門(mén)的調(diào)查處理情況等進(jìn)行描述。
(三)非臨床資料
1.產(chǎn)品風(fēng)險(xiǎn)管理資料
注冊(cè)申請(qǐng)人需對(duì)產(chǎn)品全生命周期實(shí)施風(fēng)險(xiǎn)管理,提交風(fēng)險(xiǎn)管理資料(參照GB/T 42062《醫(yī)療器械 風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》),充分識(shí)別產(chǎn)品的設(shè)計(jì)、原材料、制造過(guò)程、產(chǎn)品包裝、滅菌、運(yùn)輸、貯存、使用等產(chǎn)品生命周期內(nèi)各個(gè)環(huán)節(jié)的安全特征,從生物學(xué)危險(xiǎn)(源)、環(huán)境危險(xiǎn)(源)、種植體功能不全或種植失敗(松動(dòng)、完整性破壞)、損傷其他牙齒、感染(局部或全身感染)、術(shù)中損傷、穿孔(竇道、牙槽板)及術(shù)后并發(fā)癥、基臺(tái)功能不全(基臺(tái)與種植體不兼容)、損傷其他牙齒和毗鄰的解剖結(jié)構(gòu)等失效風(fēng)險(xiǎn),對(duì)產(chǎn)品進(jìn)行全面的風(fēng)險(xiǎn)分析,并詳述所采取的風(fēng)險(xiǎn)控制措施。
風(fēng)險(xiǎn)管理報(bào)告需包括生產(chǎn)和生產(chǎn)后信息(具體內(nèi)容參考GB/T 42062《醫(yī)療器械 風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》第9章和《醫(yī)療器械安全和性能的基本原則》的2.1.2e,f部分)。產(chǎn)品變更注冊(cè)和已在境外上市產(chǎn)品注冊(cè)時(shí),申報(bào)資料中的風(fēng)險(xiǎn)管理報(bào)告需包括上述內(nèi)容,將風(fēng)險(xiǎn)管理貫穿于產(chǎn)品的全生命周期。
2.醫(yī)療器械安全和性能基本原則清單
說(shuō)明產(chǎn)品符合《醫(yī)療器械安全和性能基本原則清單》各項(xiàng)適用要求所采用的方法,以及證明其符合性的文件。
3.產(chǎn)品技術(shù)要求的主要性能指標(biāo)
產(chǎn)品技術(shù)要求需符合相關(guān)國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)和有關(guān)法律、法規(guī)的相應(yīng)要求。在此基礎(chǔ)上,注冊(cè)申請(qǐng)人需根據(jù)產(chǎn)品的特點(diǎn),制定保證產(chǎn)品安全、有效的技術(shù)要求。產(chǎn)品技術(shù)要求中試驗(yàn)方法需依據(jù)有關(guān)國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)、國(guó)際標(biāo)準(zhǔn)制訂,或經(jīng)過(guò)確認(rèn)與驗(yàn)證。牙種植體(系統(tǒng))產(chǎn)品可參考YY 0315《鈦及鈦合金牙種植體》、YY/T 0520《鈦及鈦合金材質(zhì)牙種植體附件》、YY 0304《等離子噴涂羥基磷灰石涂層 鈦基牙種植體》、YY/T 0521《牙科學(xué) 種植體 骨內(nèi)牙種植體動(dòng)態(tài)疲勞試驗(yàn)》相關(guān)標(biāo)準(zhǔn)制定相應(yīng)性能要求。
3.1產(chǎn)品型號(hào)/規(guī)格及其劃分的說(shuō)明
列表說(shuō)明產(chǎn)品的型號(hào)、規(guī)格,明確產(chǎn)品型號(hào)、規(guī)格的劃分說(shuō)明。明示產(chǎn)品結(jié)構(gòu)組成信息。提供各型號(hào)產(chǎn)品的結(jié)構(gòu)圖并標(biāo)識(shí)關(guān)鍵尺寸。
3.2性能指標(biāo)
產(chǎn)品技術(shù)要求的主要性能指標(biāo)需包括以下適用內(nèi)容:
3.2.1各部位幾何尺寸及允差,需包括直徑、長(zhǎng)度、圓錐角。
3.2.2牙種植體與種植體基臺(tái)的配合性能,包括牙種植體與種植體基臺(tái)內(nèi)連接錐度配合及偏差、牙種植體與種植體基臺(tái)配合間隙、螺紋偏差。
3.2.3表面性能,包括外觀(guān)、表面缺陷、牙種植體頸部粗糙度(如適用)。
3.2.4清潔。
3.2.5機(jī)械性能,包括抗扭性能、緊固扭矩。
3.2.6無(wú)菌。
3.2.7細(xì)菌內(nèi)毒素。
3.2.8涂層性能(如適用),涂層抗拉粘結(jié)強(qiáng)度、微觀(guān)形貌(平均厚度、表面粗糙度、涂層形貌、孔隙率)。
3.3檢驗(yàn)方法
產(chǎn)品的檢驗(yàn)方法需根據(jù)技術(shù)性能指標(biāo)設(shè)定,優(yōu)先采用公認(rèn)的或已頒布的標(biāo)準(zhǔn)檢驗(yàn)方法,包括推薦性標(biāo)準(zhǔn),需注明相應(yīng)標(biāo)準(zhǔn)的編號(hào)和年代號(hào)。自建檢驗(yàn)方法需提供相應(yīng)的方法學(xué)依據(jù)及理論基礎(chǔ),同時(shí)保證檢驗(yàn)方法具有可操作性和可重現(xiàn)性,必要時(shí)可附相應(yīng)圖示進(jìn)行說(shuō)明,文本較大的可以附錄形式提供。
3.4附錄
產(chǎn)品各組件化學(xué)成分及符合標(biāo)準(zhǔn)信息、顯微組織/低倍組織、涂層材料信息(涂層材料、HA含量及結(jié)晶度、雜質(zhì)元素含量極限、鈣磷原子比、其他結(jié)晶相)、產(chǎn)品表面元素定性分析、疲勞極限,以資料性附錄形式體現(xiàn)。
4.同一注冊(cè)單元內(nèi)檢驗(yàn)典型性產(chǎn)品確定原則
同一注冊(cè)單元內(nèi)所檢驗(yàn)的產(chǎn)品應(yīng)當(dāng)能夠代表本注冊(cè)單元內(nèi)其他產(chǎn)品的安全性和有效性,并提供典型性檢驗(yàn)樣品的確定依據(jù)。種植體及附件需分別選取典型性產(chǎn)品,關(guān)于種植體建議選取直徑最小的產(chǎn)品。
5.研究資料
5.1產(chǎn)品性能研究
根據(jù)產(chǎn)品特性及臨床預(yù)期風(fēng)險(xiǎn),開(kāi)展物理和機(jī)械性能驗(yàn)證,可參考YY 0315、YY 0304、YY/T 0520、YY/T 0521相關(guān)標(biāo)準(zhǔn)。對(duì)于表面采用噴砂酸蝕、陽(yáng)極氧化等加工而成的鈦及鈦合金常規(guī)種植體系統(tǒng)接受限值可直接參考上述標(biāo)準(zhǔn)中明確接受閾值,對(duì)于相關(guān)標(biāo)準(zhǔn)中尚無(wú)接受閾值的性能要求,建議進(jìn)行對(duì)比研究。研究項(xiàng)目包括但不限于:
5.1.1配合性能,需提交種植體(系統(tǒng))的配合性能驗(yàn)證資料。需考慮牙種植體與種植體基臺(tái)連接處的配合、配合間隙、螺紋偏差、敲擊固位及莫氏錐度/圓錐固位精度(如適用)、拔出力(如適用)、敲擊力(如適用)、冷焊效果(如適用)性能研究資料,建議不少于3組,對(duì)于敲擊固位、莫氏錐度/圓錐固位研究建議與已上市相同固位形式產(chǎn)品進(jìn)行對(duì)比研究。
5.1.2力學(xué)性能,需結(jié)合產(chǎn)品結(jié)構(gòu)設(shè)計(jì)提交抗扭性能、緊固扭矩、旋動(dòng)扭矩、自攻性能(適用于自攻型牙種植體)、軸向拔出力(適用于即刻種植)研究資料。
5.1.3疲勞極限:需結(jié)合產(chǎn)品結(jié)構(gòu)設(shè)計(jì)及配合使用的情形,選取申報(bào)產(chǎn)品中力學(xué)性能最差產(chǎn)品參照YY/T 0521《牙科學(xué) 種植體 骨內(nèi)牙種植體動(dòng)態(tài)疲勞試驗(yàn)》開(kāi)展疲勞極限研究,并對(duì)試驗(yàn)結(jié)果的可接受性進(jìn)行分析,可選擇與已上市產(chǎn)品疲勞性能對(duì)比分析,建議注意申報(bào)產(chǎn)品和同品種產(chǎn)品疲勞性能測(cè)試條件的一致性。對(duì)于小直徑種植體疲勞極限較低,僅可滿(mǎn)足前牙區(qū)使用的情況,建議一并選擇后牙區(qū)可用最小直徑種植體(系統(tǒng))開(kāi)展疲勞極限或較大載荷值的疲勞驗(yàn)證研究。對(duì)于特殊設(shè)計(jì)的種植體(系統(tǒng)),如穿顴種植體,需結(jié)合臨床應(yīng)用形式選取合適的疲勞試驗(yàn)?zāi)P停峁┰囼?yàn)?zāi)P驮O(shè)計(jì)依據(jù),并對(duì)試驗(yàn)結(jié)果進(jìn)行可接受性分析。
5.1.4耐腐蝕性能:若種植體系統(tǒng)包含不同種類(lèi)的金屬組件且以前未見(jiàn)相似的用法時(shí),需進(jìn)行申報(bào)產(chǎn)品的耐腐蝕性能研究。申報(bào)產(chǎn)品的配合方式在目前境內(nèi)已上市產(chǎn)品中有相同的用法時(shí),可不進(jìn)行該項(xiàng)研究。
5.1.5表面性能:需明確申報(bào)產(chǎn)品的表面處理方法,包括噴砂酸蝕、陽(yáng)極氧化及其他表面處理,提供表面處理工藝驗(yàn)證及表面形態(tài)特征的研究驗(yàn)證資料,一般需包括表面形貌、微觀(guān)結(jié)構(gòu)、表面化學(xué)分析、涂層均勻性、涂層剝脫/磨損、溶解性、種植體頸部及根部表面粗糙度等,具體如下:
5.1.5.1對(duì)于陶瓷涂層,需提供以下信息:涂層材料粉末顆粒大小及粒度分布、化學(xué)成分及化學(xué)性質(zhì)分析、X射線(xiàn)衍射圖譜;涂層制備工藝、后處理工藝及其特點(diǎn),包括涂層的平均孔徑、孔隙率、表面涂層表面和截面掃描電鏡照片、厚度和公差、所有晶相的百分比、X射線(xiàn)衍射圖譜、磨損、脫落或脫離、溶解性、抗拉粘結(jié)強(qiáng)度。
5.1.5.2對(duì)于金屬涂層,需提供以下信息:涂層材料的化學(xué)成分及涂層自身的化學(xué)成分、涂層厚度及孔隙率、孔隙截距、表面形態(tài)特征、晶相及非晶相比例及分布、種植體涂層表面和截面掃描電鏡照片、涂層磨損、脫落或脫離和溶解性。
5.1.5.3對(duì)于噴砂處理,需提供以下信息:噴砂處理種植體表面特征、所使用噴砂粒子的化學(xué)成分、噴砂工藝特征(如壓力、噴砂時(shí)間、噴砂角度等)、噴砂粒子殘留、用于去除噴砂粒子的物質(zhì)的理化特性及其工藝過(guò)程、種植體表面分析及種植體表面微觀(guān)結(jié)構(gòu)分析。
5.1.5.4對(duì)于酸蝕處理,需提供以下信息:種植體表面處理所用酸蝕劑的化學(xué)成分,處理工藝,處理后種植體表面酸蝕層的形態(tài)特征、表面化學(xué)組成分析及分析方法、掃描電鏡照片。應(yīng)當(dāng)控制酸蝕劑的殘留量。
5.1.5.5對(duì)于鹽涂層,需提供以下信息:化學(xué)成分、涂層厚度、孔徑及孔隙覆蓋率、粗糙度、表面形貌、磨損特性、沉積鹽量、溶解性、親水接觸角、沉積鹽量對(duì)牙槽骨組織的影響。
5.1.5.6其他處理
若對(duì)種植體表面進(jìn)行其他技術(shù)處理,對(duì)于具有特殊宣稱(chēng)(如親水性、利于細(xì)胞黏附、提高初期穩(wěn)定性等)、或首次上市的表面處理工藝,還需針對(duì)宣稱(chēng)提供相應(yīng)的證據(jù)及支持性資料,提供該表面處理工藝對(duì)產(chǎn)品安全有效性的研究驗(yàn)證資料。
5.1.6穩(wěn)定性能:種植體較已上市產(chǎn)品表面處理、結(jié)構(gòu)形式存在差異,如特殊規(guī)格種植體,直徑小于3.25mm、長(zhǎng)度小于7mm、特殊表面處理、即刻負(fù)重及新的應(yīng)用技術(shù)等,且差異部分可能影響產(chǎn)品的穩(wěn)定性/骨結(jié)合性能,需補(bǔ)充申報(bào)產(chǎn)品的種植體初期穩(wěn)定性(如種植體穩(wěn)定系數(shù))、骨結(jié)合、骨吸收水平研究,評(píng)估種植體初期穩(wěn)定性水平,結(jié)合產(chǎn)品技術(shù)特征,需要提交長(zhǎng)期穩(wěn)定性評(píng)估研究資料,建議合并動(dòng)物試驗(yàn)研究。
5.2化學(xué)/材料表征研究
牙科種植體(系統(tǒng))中各組件需說(shuō)明材料的選擇依據(jù)、材料來(lái)源,對(duì)所選用的材料應(yīng)當(dāng)進(jìn)行質(zhì)量控制并符合相關(guān)材料標(biāo)準(zhǔn)要求,材料需具有穩(wěn)定的供貨渠道以保證產(chǎn)品質(zhì)量,外購(gòu)材料需提供材料的供方名錄。需提供各組件材料化學(xué)及力學(xué)性能驗(yàn)證資料,如化學(xué)成分、顯微組織、晶粒度、涂層成分、表面元素分析、相對(duì)雜質(zhì)含量及其上限、溶解性、金屬材料力學(xué)性能(抗拉強(qiáng)度、0.2%規(guī)定非比例延伸強(qiáng)度、斷裂伸長(zhǎng)率、斷面收縮率(如適用)、彈性模量(如適用))、陶瓷材料彎曲強(qiáng)度及抗沖擊韌性、復(fù)合材料的彎曲強(qiáng)度及彈性模量。
5.3生物學(xué)特性研究
對(duì)于牙科種植體(系統(tǒng))中包含的組件、配件,需根據(jù)組件或配件與口腔組織的接觸類(lèi)型和時(shí)間,充分評(píng)價(jià)組件或配件的生物相容性。牙科種植體(系統(tǒng))的生物相容性評(píng)價(jià)需遵循GB/T 16886.1《醫(yī)療器械生物學(xué)評(píng)價(jià)第1部分:風(fēng)險(xiǎn)管理過(guò)程中的評(píng)價(jià)與試驗(yàn)》和YY/T 0268《牙科學(xué)口腔醫(yī)療器械生物學(xué)評(píng)價(jià)第1單元:評(píng)價(jià)與試驗(yàn)》相關(guān)要求,生物相容性評(píng)價(jià)資料可以參考《醫(yī)療器械生物學(xué)評(píng)價(jià)指南》,必要時(shí),開(kāi)展生物學(xué)試驗(yàn)。生物學(xué)評(píng)價(jià)終點(diǎn)一般包括細(xì)胞毒性、致敏性、急性全身毒性、刺激或皮內(nèi)反應(yīng)(或口腔粘膜刺激試驗(yàn))、遺傳毒性、亞慢性全身毒性、局部植入反應(yīng)、材料介導(dǎo)致熱性,其中局部植入反應(yīng)需根據(jù)產(chǎn)品預(yù)期使用位置選擇合適的方式,如骨水平種植體需考慮骨埋植,軟組織水平種植體需考慮骨埋植及皮下植入試驗(yàn)。
采用符合GB/T 13810、ISO 5832-2、ISO 5832-3、ISO 5832-11或ASTM F67、ASTM F136、ASTM F1295、ASTM F1472等相關(guān)標(biāo)準(zhǔn)的外科植入物用鈦及鈦合金材料制成的產(chǎn)品,且器械表面未經(jīng)改性處理或僅經(jīng)噴砂處理,可申請(qǐng)豁免進(jìn)行生物相容性檢測(cè),需交生物相容性評(píng)價(jià)報(bào)告。
5.4清洗和滅菌研究
5.4.1清洗
明確生產(chǎn)工藝中涉及的各種加工助劑(如切削液、酸蝕劑等)的質(zhì)量控制標(biāo)準(zhǔn)。明確產(chǎn)品的清洗過(guò)程,提供經(jīng)清洗過(guò)程后加工助劑殘留控制的驗(yàn)證資料。對(duì)生產(chǎn)加工過(guò)程使用的所有加工助劑等添加劑均需說(shuō)明使用劑量、對(duì)殘留量的控制措施和接受標(biāo)準(zhǔn)以及安全性評(píng)價(jià)報(bào)告。
5.4.2滅菌研究
描述用于保證產(chǎn)品無(wú)菌的質(zhì)量保證體系,明確滅菌工藝(方法和參數(shù))和無(wú)菌保證水平(SAL)。產(chǎn)品的無(wú)菌保證水平(SAL)需達(dá)到10-6。
5.4.2.1生產(chǎn)企業(yè)滅菌
對(duì)于經(jīng)輻射滅菌的產(chǎn)品,需明確輻射劑量及相關(guān)的驗(yàn)證報(bào)告,具體的劑量確定依據(jù)可參照GB 18280系列標(biāo)準(zhǔn)。
5.4.2.2最終使用者滅菌
對(duì)于非滅菌包裝的終產(chǎn)品,需明確推薦采用的滅菌方法并提供確定依據(jù),并提供驗(yàn)證資料。
5.5動(dòng)物試驗(yàn)研究
請(qǐng)根據(jù)《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分:決策原則》要求,結(jié)合動(dòng)物試驗(yàn)“替代、減少和優(yōu)化”原則及醫(yī)療器械風(fēng)險(xiǎn)管理原則判定開(kāi)展動(dòng)物試驗(yàn)的必要性。如需開(kāi)展動(dòng)物試驗(yàn),請(qǐng)參照《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第二部分:實(shí)驗(yàn)設(shè)計(jì)、實(shí)施質(zhì)量保證》進(jìn)行研究方案設(shè)計(jì)和實(shí)施質(zhì)量保證工作。可參考YY/T 0522《牙科學(xué) 牙種植體系統(tǒng)臨床前評(píng)價(jià) 動(dòng)物試驗(yàn)方法》或其他適合的動(dòng)物試驗(yàn)方法。對(duì)于擬開(kāi)展動(dòng)物試驗(yàn)的,需明確動(dòng)物試驗(yàn)?zāi)康摹?dòng)物種屬、性別、月齡、數(shù)量的選擇確定依據(jù);對(duì)照組的選擇及設(shè)立的目的及試驗(yàn)位置;觀(guān)察指標(biāo)需考慮生化指標(biāo)、大體數(shù)據(jù)、CT、免疫組化數(shù)據(jù)、初期穩(wěn)定性(如植入扭矩、種植體穩(wěn)定系數(shù))、骨結(jié)合性能(如骨結(jié)合率)、骨吸收水平等數(shù)據(jù),合理設(shè)定觀(guān)察周期并關(guān)注動(dòng)物模型建立的科學(xué)性和合理性,以及對(duì)臨床的借鑒意義。
5.6穩(wěn)定性研究
5.6.1貨架有效期
注冊(cè)申請(qǐng)人需參照《無(wú)菌醫(yī)療器械包裝試驗(yàn)方法第1部分:加速老化試驗(yàn)指南》或《無(wú)源植入性醫(yī)療器械貨架有效期注冊(cè)申報(bào)資料指導(dǎo)原則》中適用的部分提供加速穩(wěn)定性試驗(yàn)或?qū)崟r(shí)穩(wěn)定性試驗(yàn)驗(yàn)證資料。對(duì)于含保存液包裝產(chǎn)品穩(wěn)定性試驗(yàn)需考慮保存液在種植體表面的沉淀及保存液與包裝浸提情況,如選用加速穩(wěn)定性試驗(yàn)需提交加速溫度的選擇依據(jù)。
5.6.2運(yùn)輸穩(wěn)定性
注冊(cè)申請(qǐng)人需提交運(yùn)輸穩(wěn)定性驗(yàn)證資料,證明在規(guī)定的運(yùn)輸條件下,運(yùn)輸過(guò)程中環(huán)境條件(例如:震動(dòng)、振動(dòng)、溫度和濕度的波動(dòng))不會(huì)對(duì)醫(yī)療器械的特性和性能,包括完整性和清潔度,造成不利影響。
5.7免于臨床評(píng)價(jià)支持資料
對(duì)于牙科種植體(系統(tǒng))中覆蓋螺絲、中央螺釘、直型基臺(tái)、愈合基臺(tái)、臨時(shí)基臺(tái)組件已列入《免于臨床評(píng)價(jià)醫(yī)療器械目錄》(以下簡(jiǎn)稱(chēng)《目錄》)的產(chǎn)品,注冊(cè)申請(qǐng)人需提交申報(bào)產(chǎn)品相關(guān)信息與《目錄》所述內(nèi)容的對(duì)比資料以及申報(bào)產(chǎn)品與已獲準(zhǔn)境內(nèi)注冊(cè)的《目錄》中醫(yī)療器械的對(duì)比說(shuō)明。關(guān)于申報(bào)產(chǎn)品與已獲準(zhǔn)境內(nèi)注冊(cè)的《目錄》中醫(yī)療器械的對(duì)比項(xiàng)目中結(jié)構(gòu)組成的對(duì)比需包括產(chǎn)品基體材質(zhì)及符合的標(biāo)準(zhǔn)、表面處理情況;性能要求的對(duì)比需考慮結(jié)構(gòu)及尺寸、配合性能、機(jī)械性能(緊固扭矩、抗扭性能、疲勞極限)的對(duì)比。針對(duì)對(duì)比資料中的差異部分,宜提交申報(bào)產(chǎn)品自身的非臨床研究資料證明差異性對(duì)臨床使用的安全性有效性未產(chǎn)生不利影響,證明申報(bào)產(chǎn)品與《目錄》所述產(chǎn)品具有基本等同性。
使用了新材料、活性成分、新技術(shù)、新設(shè)計(jì)或具有新作用機(jī)理、新功能的產(chǎn)品,不屬于《目錄》描述范圍的產(chǎn)品,注冊(cè)申請(qǐng)人宜選擇合適的臨床評(píng)價(jià)路徑進(jìn)行評(píng)價(jià)。
(四)臨床評(píng)價(jià)資料
注冊(cè)申請(qǐng)人需在滿(mǎn)足注冊(cè)法規(guī)要求的前提下,按照《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》的要求選擇合適的臨床評(píng)價(jià)路徑提交臨床評(píng)價(jià)資料。
1.同品種醫(yī)療器械臨床數(shù)據(jù)
詳見(jiàn)《牙科種植體系統(tǒng)同品種臨床評(píng)價(jià)注冊(cè)審查指導(dǎo)原則》中將同品種醫(yī)療器械的臨床數(shù)據(jù)用于支持申報(bào)產(chǎn)品的安全性、臨床性能和/或有效性的要求。
2.申報(bào)產(chǎn)品臨床試驗(yàn)數(shù)據(jù)
如需開(kāi)展臨床試驗(yàn),申請(qǐng)人可參照《決策是否開(kāi)展醫(yī)療器械臨床試驗(yàn)技術(shù)指導(dǎo)原則》明確需要開(kāi)展臨床試驗(yàn)的主要考慮因素,若開(kāi)展申報(bào)產(chǎn)品臨床試驗(yàn),則需嚴(yán)格按照《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》進(jìn)行臨床試驗(yàn),并提交完整的臨床試驗(yàn)資料。臨床試驗(yàn)的設(shè)計(jì)可參考《醫(yī)療器械臨床試驗(yàn)設(shè)計(jì)指導(dǎo)原則》。
申請(qǐng)人如有境外臨床試驗(yàn)數(shù)據(jù),可參照《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》的要求提交相關(guān)資料。
(五)產(chǎn)品說(shuō)明書(shū)和標(biāo)簽樣稿
產(chǎn)品說(shuō)明書(shū)和標(biāo)簽需符合《醫(yī)療器械說(shuō)明書(shū)和標(biāo)簽管理規(guī)定》和YY/T 0466.1《醫(yī)療器械用于醫(yī)療器械標(biāo)簽、標(biāo)記和提供信息的符號(hào)第1部分:通用要求》中的相關(guān)要求。與申報(bào)產(chǎn)品預(yù)期配合使用的醫(yī)療器械,需在說(shuō)明書(shū)中明確配合使用產(chǎn)品信息。
(六)質(zhì)量管理體系文件
按照《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》提交相關(guān)文件。
三、參考文獻(xiàn)
[1] 中華人民共和國(guó)國(guó)務(wù)院.醫(yī)療器械監(jiān)督管理?xiàng)l例:中華人民共和國(guó)國(guó)務(wù)院令第739號(hào)[Z].
[2] 國(guó)家市場(chǎng)監(jiān)督管理總局.醫(yī)療器械注冊(cè)與備案管理辦法:國(guó)家市場(chǎng)監(jiān)督管理總局令第47號(hào)[Z].
[3] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式:關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告2021年第121號(hào)[Z]
[4] 原國(guó)家食品藥品監(jiān)督管理總局.醫(yī)療器械說(shuō)明書(shū)和標(biāo)簽管理規(guī)定:國(guó)家食品藥品監(jiān)督管理總局令第6號(hào)[Z].
[5] 原國(guó)家食品藥品監(jiān)督管理總局.醫(yī)療器械分類(lèi)規(guī)則:國(guó)家食品藥品監(jiān)督管理總局令第15號(hào)[Z].
[6] 原國(guó)家食品藥品監(jiān)督管理總局.醫(yī)療器械通用名稱(chēng)命名規(guī)則:國(guó)家食品藥品監(jiān)督管理總局令第19號(hào)[Z].
[7] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械分類(lèi)目錄: 總局關(guān)于發(fā)布醫(yī)療器械分類(lèi)目錄的公告2017年第104號(hào)[Z].
[8] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則: 總局關(guān)于發(fā)布醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則的通告2017年第187號(hào)[Z].
[9] 國(guó)家藥監(jiān)局器審中心.無(wú)源植入性醫(yī)療器械穩(wěn)定性研究指導(dǎo)原則(2022年修訂版):國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布無(wú)源植入性醫(yī)療器械穩(wěn)定性研究指導(dǎo)原則(2022年修訂版)的通告2022年第12號(hào)[Z].
[10] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則第一部分:決策原則(2021年修訂版): 國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則 第一部分:決策原則(2021年修訂版)等2項(xiàng)注冊(cè)審查指導(dǎo)原則的通告2021年第75號(hào)[Z].
[11] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則 第二部分:試驗(yàn)設(shè)計(jì)、實(shí)施質(zhì)量保證: 國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則 第一部分:決策原則(2021年修訂版)等2項(xiàng)注冊(cè)審查指導(dǎo)原則的通告2021年第75號(hào)[Z].
[12] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則:國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則等5項(xiàng)技術(shù)指導(dǎo)原則的通告2021年第73號(hào) [Z].
[13] 國(guó)家藥品監(jiān)督管理局.口腔科器械通用名稱(chēng)命名指導(dǎo)原則:國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)用成像器械通用名稱(chēng)命名指導(dǎo)原則等3項(xiàng)指導(dǎo)原則的通告2020年第41號(hào)[Z].
[14] YY 0315,鈦及鈦合金牙種植體 [S].
[15] YY/T 0520, 鈦及鈦合金材質(zhì)牙種植體附件 [S].
[16] YY 0304, 等離子噴涂羥基磷灰石涂層 鈦基牙種植體 [S].
[17] YY/T 0521, 牙科學(xué) 種植體 骨內(nèi)牙種植體動(dòng)態(tài)疲勞試驗(yàn) [S].
[18] GB/T 16886.1,醫(yī)療器械生物學(xué)評(píng)價(jià)第1部分:風(fēng)險(xiǎn)管理過(guò)程中的評(píng)價(jià)與試驗(yàn) [S]. [19] GB/T 16886.3,醫(yī)療器械生物學(xué)評(píng)價(jià) 第3部分:遺傳毒性、致癌性和生殖毒性試驗(yàn) [S].
[20] GB/T 16886.5,醫(yī)療器械生物學(xué)評(píng)價(jià) 第5部分:體外細(xì)胞毒性試驗(yàn)[S].
[21] GB/T 16886.10,醫(yī)療器械生物學(xué)評(píng)價(jià) 第10部分:刺激與皮膚致敏試驗(yàn)[S].
[22] GB/T 16886.11,醫(yī)療器械生物學(xué)評(píng)價(jià) 第11部分:全身毒性試驗(yàn)[S].
[23] YY/T 0268,牙科學(xué) 口腔醫(yī)療器械生物學(xué)評(píng)價(jià) 第1單元:評(píng)價(jià)與試驗(yàn)[S].
[24] GB/T 42062,醫(yī)療器械 風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用[S].
[25] YY/T 0466.1,醫(yī)療器械 用于醫(yī)療器械標(biāo)簽、標(biāo)記和提供信息的符號(hào)第1部分:通用要求[S].
如有牙科種植體系統(tǒng)注冊(cè)及臨床試驗(yàn)服務(wù)需求,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢(xún)有限公司聯(lián)絡(luò),聯(lián)系人:葉工,電話(huà):18058734169,微信同。