- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
一文讀懂手術包類醫療器械注冊要點難點 手術包類醫療器械注冊產品相比常規醫療器械,有更多的組件、更多的組合,以及更難的醫療器械注冊單元劃分,更復雜的產品技術要求和醫療器械注冊檢驗要求和準備工作,本文為大家說說常見手術包類醫療器械注冊要點難點。 時間:2024-5-3 20:17:16 瀏覽量:773

-
義齒制作用合金、正畸絲應如何劃分醫療器械注冊單元 繼續為大家介紹義齒類醫療器械注冊要點,考慮到義齒產品注冊單元劃分是高頻咨詢事項,本文為大家說說義齒制作用合金、正畸絲的醫療器械注冊單元劃分。 時間:2024-5-2 19:47:08 瀏覽量:484

-
3D激光熔鑄鈷鉻合金烤瓷冠、橋的管理屬性和類別是什么? 經常有客戶問到我有關定制式固定義齒注冊產品的管理屬性和類別,因為定制式原因,其與常規醫療器械注冊產品生產加工來說存在較大差異,本文為大家說說3D激光熔鑄鈷鉻合金烤瓷冠、橋的醫療器械分類。 時間:2024-5-2 19:42:01 瀏覽量:617

-
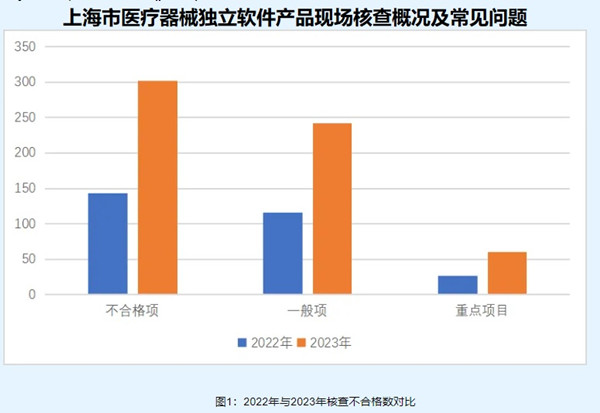
上海市醫療器械獨立軟件產品現場核查概況及常見問題 醫療器械獨立軟件注冊是近年增速較快的醫療器械產品類別,考慮到軟件生產與常規醫療器械生產差異較大,本文為大家分享2023年上海市醫療器械獨立軟件產品現場核查概況及常見問題,幫助大家理解醫療器械獨立軟件注冊體考相關要求和尺度。 時間:2024-5-1 0:00:00 瀏覽量:563
-
中國、美國、歐盟醫療器械可用性工程監管要求比較 醫療器械可用性工程文檔是近年全球主要醫療器械監管組織提出的新要求,可用性工程就是“以用戶為中心”的設計,目的是增強醫療器械的可用性。本文為大家比較中國、美國、歐盟醫療器械可用性工程監管要求。 時間:2024-5-1 22:39:16 瀏覽量:625

-
美國FDA醫療器械可用性監管要求 ?可用性工程就是“以用戶為中心”的設計,目的是增強醫療器械的可用性。其中,用戶是指醫療氣息的注冊申請人所規定的與醫療器械交互的全部人員,醫生、護士、患者等用戶組需要重點關注。醫療器械可用型工程文檔是有關可用型工程的描述文檔,本文為大家說說美國FDA醫療器械可用性監管要求。 時間:2024-4-30 19:51:30 瀏覽量:542

-
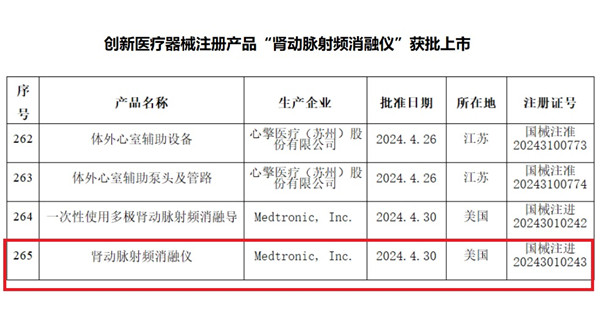
創新醫療器械注冊產品“腎動脈射頻消融儀”獲批上市 2024年4月30日,國家藥監局發布《一次性使用多極腎動脈射頻消融導管和腎動脈射頻消融儀獲批上市》公告文件,近日,國家藥品監督管理局批準了美敦力公司“一次性使用多極腎動脈射頻消融導管”和“腎動脈射頻消融儀”創新醫療器械注冊產品注冊申請。 時間:2024-4-30 19:35:34 瀏覽量:582
-
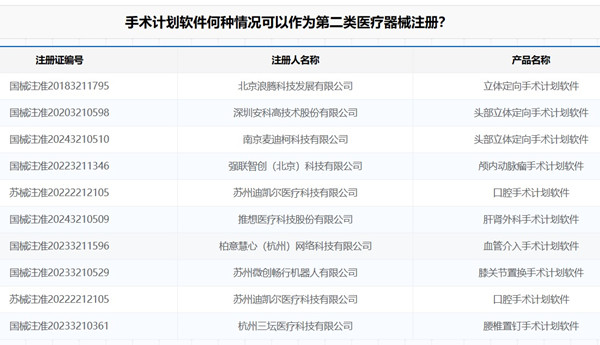
手術計劃軟件何種情況可以作為第二類醫療器械注冊? 手術計劃類軟件是一類非常特殊的類別,依據其預期用途的不同,可能作為醫療器械管理,可能作為非醫療器械管理;可能作為第三類醫療器械管理,也可能作為第二類醫療器械管理,本文為大家說說哪些情況手術計劃類軟件作為第二類醫療器械注冊管理。 時間:2024-4-29 0:00:00 瀏覽量:470
-
藻酸鹽敷料注冊審查指導原則(征求意見稿) 2024年4月28日,根據國家藥品監督管理局2024年度醫療器械注冊?審查指導原則制修訂計劃的有關要求,國家藥監局器審中心組織編制了《藻酸鹽敷料注冊審查指導原則》,并面向公眾公開征求意見。 時間:2024-4-29 0:00:00 瀏覽量:540
-
云南某中醫院使用過期醫療器械注冊產品被罰56864元 醫療器械效期管理即是醫療器械生產企業的職責,也是醫療器械經營企業和醫療器械使用單位的職責。效期管理應不銷售和使用過期醫療器械,應慎重對待臨效期醫療器械。近日,國家喲啊間距公布典型醫療器械違法案例,其中,云南省元陽縣中醫醫院使用過期醫療器械注冊產品被罰56864元。 時間:2024-4-27 21:34:46 瀏覽量:510

-
鄂爾多斯某公司經營未取得醫療器械注冊證產品被罰5萬 對于醫療器械經營許可或是醫療器械經營備案企業來說,關注供應商是否具備合法資質是基本要求,今日,國家局公布醫療器械典型違法案例,其中,鄂爾多斯市聯康商貿有限公司經營未取得醫療器械注冊證產品被罰50000元。 時間:2024-4-27 21:20:58 瀏覽量:541

-
蘇州某公司辦理第二類醫療器械經營備案提交虛假人員資料被罰 ?蘇州第二類醫療器械經營備案是蘇州市市場監督管理局歸口管理項目,在申請第二類醫療器械經營備案時,企業應提供真實資料。近日,國家藥監局國家藥監局公布6起醫療器械違法案件典型案例信息,其中蘇州濤冬康貿易有限公司提交第二類醫療器械經營備案虛假資料(法定代表人和質量負責人的個人資料?)被罰2萬元。 時間:2024-4-26 19:59:16 瀏覽量:758

-
上海X公司未經許可生產未取得醫療器械注冊證被罰375630元 ?2024年4月25日,國家藥監局公布6起醫療器械違法案件典型案例信息,其中上海優婭醫藥科技有限公司未經許可生產未取得醫療器械注冊證第二類醫療器械案,被罰375630元,一起關注具體情況! 時間:2024-4-26 19:44:17 瀏覽量:593

-
有源醫療器械注冊產品外形和功能都發生變化,是否還在變更的范疇? 醫療器械變更注冊隱藏一個“度”的問題,即什么情況下屬于變更,什么情況要按照醫療器械首次注冊辦理,這個“度”就是差異的性質和程度。比如,有源醫療器械注冊產品外形和功能都發生變化,是否還在變更的范疇?一起看正文。 時間:2024-4-25 19:25:35 瀏覽量:448

-
結構有所差異,是否可以通過醫療器械變更注冊增加型號? 對于企業在已取得醫療器械注冊證的情況下,增加與已注冊產品有差異的產品,是按照醫療器械首次注冊處理,還是按照醫療器械變更注冊處理?一起看正文。 時間:2024-4-25 19:19:08 瀏覽量:492

-
如何界定人工智能醫用軟件的管理類別? 人工智能(AI)是指通過模擬、延伸或擴展人類的智能功能來創建的一種技術。它涵蓋了諸如機器學習、深度學習、自然語言處理、計算機視覺等領域。人工智能的目標是使計算機系統能夠執行通常需要人類智能的任務,AI 的發展已經影響到了幾乎所有領域,本文為大家說說人工智能醫用軟件管理類別的界定。 時間:2024-4-24 0:00:00 瀏覽量:479

-
產品包含軟件僅實現產品的部分功能,軟件是否可以單獨注冊? 因為軟件本身的無形性和易擴展型,醫療器械軟件注冊相比其他類型醫療器械更加靈活,經常有客戶問我,擬申請醫療器械注冊產品包含軟件,該軟件實現產品的部分功能,該軟件是否可以單獨注冊?一起看正文。 時間:2024-4-24 21:49:00 瀏覽量:555

-
醫療器械注冊產品生物相容性評價是否可以引用其他同類產品的生物學試驗報告? 對于醫療器械注冊產品生物相容性評價,在之前的文章中有給大家講到通過生物相容性試驗是途徑之一,還有其它生物學評價途徑。本文為大家說說醫療器械注冊產品的生物相容性評價是否可以引用其他同類產品資料,一起看正文。 時間:2024-4-23 19:00:33 瀏覽量:559

-
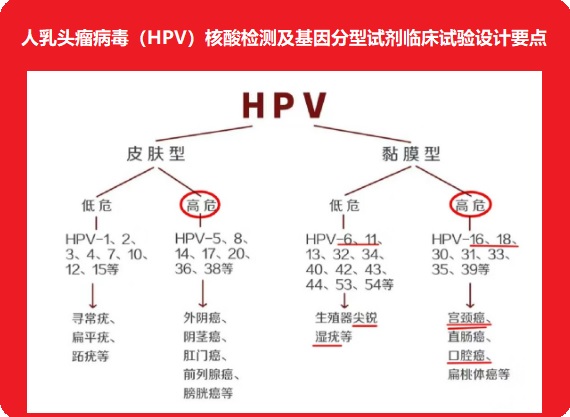
人乳頭瘤病毒(HPV)核酸檢測及基因分型試劑臨床試驗設計要點 人乳頭瘤病毒(HPV)核酸檢測及基因分型試劑是指利用包括PCR-熒光探針法或其他分子生物學方法在內的核酸檢測技術,以特定高危型HPV核酸(包括DNA和RNA)序列為檢測目的,對人宮頸脫落上皮細胞進行體外定性檢測的試劑,以確定受試樣本中是否存在高于陽性判斷值水平的高危型HPV病毒,或同時鑒定感染HPV的基因型別。 時間:2024-4-23 18:53:20 瀏覽量:700
-
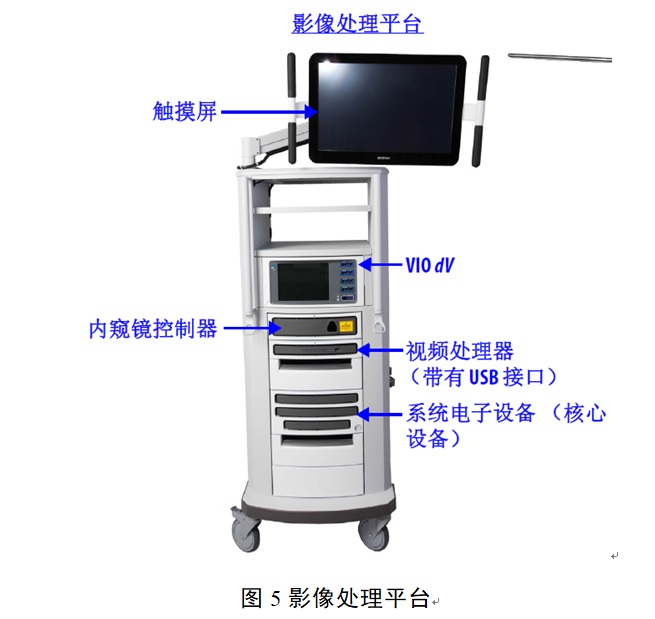
腹腔內窺鏡手術系統臨床試驗設計要點及注意事項 多孔腹腔內窺鏡手術系統(簡稱手術系統)通常包括醫生控制臺、患者手術平臺、影像處理平臺、三維腹腔內窺鏡(簡稱內窺鏡)、手術器械等。按現行《醫療器械分類目錄》,該類產品在我國屬于第三類醫療器械注冊產品,分類編碼為01-07-03。本文為大家說說腹腔內窺鏡手術系統臨床試驗設計要點及注意事項。 時間:2024-4-22 20:35:03 瀏覽量:634